结直肠癌(Colorectal Cancer,CRC)是全世界范围内发病率第三的癌症,每年新增发病人数近200万(仅次于乳腺癌和肺癌),每年导致的死亡人数接近100万(仅次于肺癌)。大约每25个人就有1人会在其一生中患上结直肠癌。而在我国,结直肠癌年发病人数仅次于肝癌,2020年新增56万结直肠癌患者。更重要的是,近30年来,50岁以下的年轻人群中结直肠癌的发病率一直在上升。
错配修复缺陷和微卫星不稳定性高(d-MMR/MSI-H)代表了一种独特的生物标志物定义的癌症群体,约占所有结直肠癌(CRC)的15%。相比错配修复熟练和微卫星稳定(pMMR/MSS)的结直肠癌,错配修复缺陷和微卫星不稳定性高(d-MMR/MSI-H)的结直肠癌具有更高的肿瘤新抗原负荷和更密集的免疫细胞浸润,这表明免疫检查点抑制剂(ICI)疗法对其更具益处。临床数据也证实了这一点,靶向PD-1/PD-L1通路的免疫检查点抑制剂对错配修复缺陷和微卫星不稳定性高(d-MMR/MSI-H)患者非常有效。
然而,有高达50%的转移性错配修复缺陷和微卫星不稳定性高(d-MMR/MSI-H)结直肠癌患者对免疫治疗具有耐药性,因此,亟需解决与免疫检查点抑制剂(ICI)治疗相关的挑战,以提高当前治疗方案的疗效。
2023年5月11日,中山大学附属第六医院邓艳红团队在 Cancer Cell 期刊发表了题为:Remodeling of the immune and stromal cell compartment by PD-1 blockade in mismatch repair-deficient colorectal cancer 的研究论文。
该研究阐明了免疫检查点抑制剂(ICI)治疗期间的关键免疫细胞和基质细胞亚群的动态变化,并为错配修复缺陷和微卫星不稳定性高(d-MMR/MSI-H)结直肠癌患者对PD-1阻断疗法的不同反应的细胞基础提供了新的见解。
该研究也提供了炎症和免疫检查点抑制剂(ICI)诱导的治疗反应之间关联的证据。这项研究为免疫检查点抑制剂(ICI)成功治疗的机制和提高治疗效果的潜在靶点提供了宝贵的资源和生物学见解。

免疫检查点抑制剂(ICI)治疗完全缓解的潜在机制尚未完全了解,这阻碍了目前对错配修复缺陷和微卫星不稳定性高(d-MMR/MSI-H)结直肠癌治疗效果和方案的改进。
来自bulk RNA测序和多重免疫荧光的基因表达特征的新证据表明,免疫检查点抑制剂(ICI)的疗效在很大程度上取决于肿瘤免疫微环境(TIME)。之前有研究显示,错配修复缺陷和微卫星不稳定性高(d-MMR/MSI-H)结直肠癌对PD-1抑制剂的反应与肿瘤突变负荷无关,而与高克隆扩增的T细胞有关。此外,错配修复缺陷(d-MMR)结直肠癌在免疫检查点抑制剂(ICI)治疗后CD3+T细胞和CD8+T细胞浸润以及干扰素-γ值显著升高。
然而,这些研究主要依赖于对大量肿瘤的测量分析技术,这限制了它们捕捉细胞异质性和全面探索免疫成分或细胞相互作用变化的能力。单细胞RNA测序(scRNA-seq)的最新进展为在细胞分辨率上探索免疫检查点抑制剂(ICI)治疗反应中的细胞类型特异性模式和相互作用提供了新途径。
最近已有研究团队发表了免疫治疗后实体瘤(例如乳腺癌、黑色素瘤)中肿瘤免疫微环境(TIME)的单细胞分析研究,但尚不清楚如何将这些发现应用于结直肠癌免疫治疗的研究。特别是,还没有结直肠癌免疫治疗前后的单细胞分析研究发表。
在这篇发表在 Cancer Cell 的最新研究中,邓艳红团队首次从前瞻队列中对PD-1抑制剂(特瑞普利单抗,君实生物研发)或特瑞普利单抗与COX-2抑制剂(塞来昔布)联用治疗的错配修复缺陷和微卫星不稳定性高(d-MMR/MSI-H)结直肠癌患者的细胞群进行了深入的细胞和分子层面的分析。
该研究旨在揭示术后残余肿瘤的患者对免疫检查点抑制剂(ICI)治疗的耐药性和敏感性的基础,并提示ICI的潜在治疗靶点。研究团队比较了实现病理完全缓解(pCR)的患者在免疫检查点抑制剂(ICI)治疗前后的细胞类型分布和功能变化,以阐明ICI治疗成功的相关机制。研究团队还分析了pCR和非pCR反应在治疗动力学上的差异,以探讨免疫治疗耐药的机制。
具体来说,研究团队利用单细胞RNA测序技术(scRNA-seq)研究了19例接受新辅助PD-1阻断疗法的错配修复缺陷和微卫星不稳定性高(d-MMR/MSI-H)结直肠癌患者的免疫细胞和基质细胞的动态。
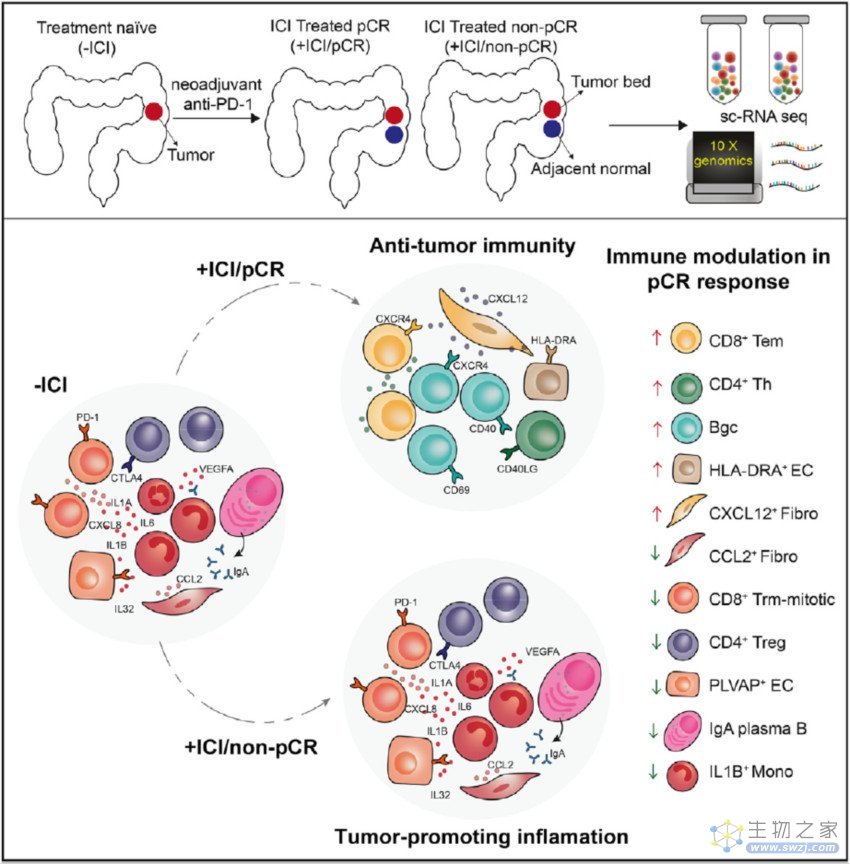
结果显示,在病理完全缓解(pCR)的肿瘤中,治疗后CD8+Trm-mitotic、CD4+Tregs、促炎IL1b+Mono和CCL2+成纤维细胞的比例一致下降,而CD8+Tem、CD4+Th、CD20+B和HLA-DRA+内皮细胞的比例增加。肿瘤微环境中的促炎特征通过调节CD8+T细胞和其他反应相关的免疫细胞群介导残留肿瘤的持续存在。这些研究结果为免疫检查点抑制剂(ICI)成功治疗的机制和提高治疗效果的潜在靶点提供了宝贵的资源和生物学见解。
论文链接:https://doi.org/10.1016/j.ccell.2023.04.011