从传统的手术,到放/化疗,再到免疫细胞疗法,肿瘤的治疗方式经历了数次突破性发展。
如今,以 CAR-T 为代表的细胞疗法成为当下肿瘤治疗的“风口”之一,由于在淋巴瘤、淋巴细胞白血病等血液肿瘤中展现出较好的临床数据,产业化进展较快。
2017 年,全球首个 CAR-T 细胞疗法(Kymriah)在美国获批上市,用于治疗儿童和年轻成年患者急性淋巴细胞性白血病。
虽然针对血液肿瘤疗效较好,但 CAR-T 细胞疗法在实体肿瘤的治疗中“表现欠佳”。长期以来,围绕 CAR-T 细胞疗法的优化改进是医学界的一大热门研究方向。

(来源:Cell)
近日,斯坦福大学亓磊实验室团队开发出一种新型 CRISPR RNA 编辑工具平台,能够在不发生永久性基因改变的情况下通过调控免疫细胞的转录组和代谢来提高其对抗肿瘤的能力,进而增强当前 CAR-T 细胞疗法的疗效。
目前,这项研究已经以“A versatile CRISPR-Cas13d platform for multiplexed transcriptomic regulation and metabolic engineering in primary human T cells”为题发表在 Cell 上。
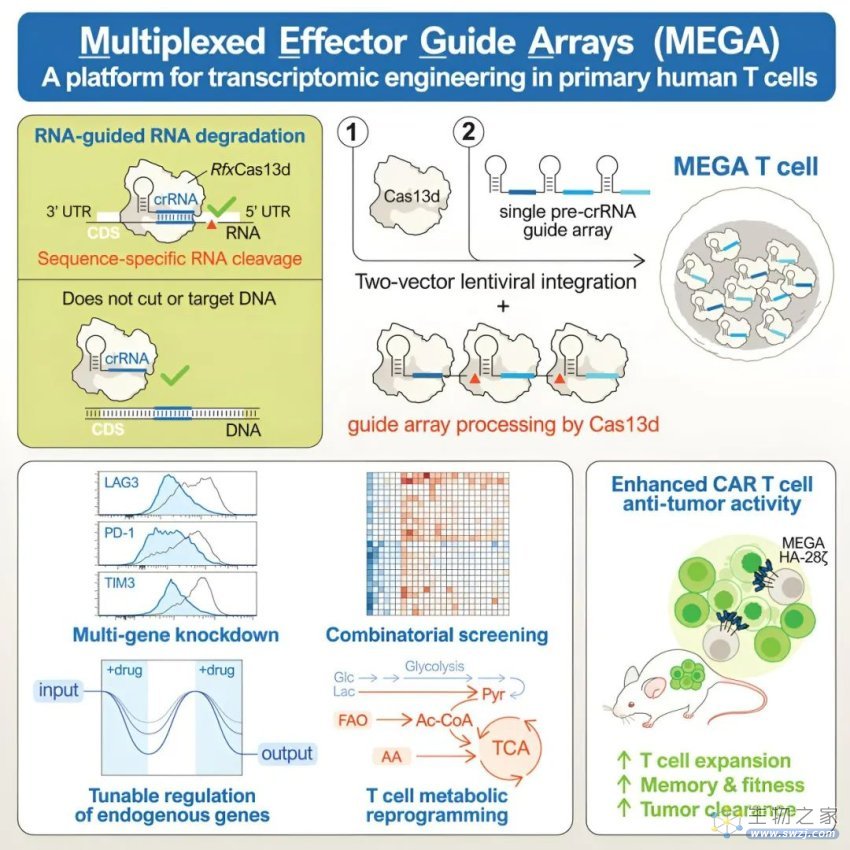
据论文介绍,他们此次开发的这种新工具名为“Multiplexed Effector Guide Arrays(MEGA)”,是一种靶向 RNA 的 CRISPR-Cas13d 基因编辑平台,通过对细胞的 RNA 进行修饰,以一种相对低风险的方式对当今的 CAR-T 细胞疗法进行改造升级。
“试验表明,在抑制肿瘤生长和维持 T 细胞长期增殖方面,我们开发的这种新工具的效果表现要好十倍。”这篇论文的共同通讯作者、斯坦福大学生物工程系副教授亓磊表示。
转录调控增强 T 细胞的肿瘤杀伤效果
CAR-T 细胞疗法,也称为抗原受体 T 细胞免疫疗法,通过提取分离患者 T 细胞在体外借助基因工程进行改造和扩增,改造成的 CAR-T 细胞带有能够识别肿瘤细胞的抗原,抗肿瘤活性明显增强,将这些细胞回输到患者体内即可特异性地攻击肿瘤细胞,从而实现快速精准治疗肿瘤的目的。
虽然 CAR-T 细胞疗法已经成功治疗了包括淋巴瘤和多发性骨髓瘤在内的血液肿瘤,但对肺癌、胰腺癌等很多实体肿瘤的治疗效果非常有限。
先前研究发现,导致疗效受限的一个主要原因在于,实体肿瘤通常拥有更大的结构,免疫细胞穿透过程中,其在杀灭肿瘤之前就已经基本消耗殆尽了。
经过改造后的 T 细胞能够迅速地对目标进行攻击,而这也意味着它们在对抗肿瘤的“持久战”中往往会过早地消耗掉能量储存而面临衰竭。类似于让一名爆发力极强的短跑运动员参加马拉松,显然他可能会在最初的一段冲刺领先,然后最终败下阵来。
此前,业界围绕 CAR-T 细胞疗法的优化通常使用 CRISPR-Cas9 来编辑细胞的 DNA,而这种基因编辑工具在安全性、有效性和范围上都受到了限制,原因在于它会永久地删除 DNA 片段,可能会带来意想不到的后果,比如导致 T 细胞本身出现癌变等。
(来源:Cell)
对此,亓磊和团队采用了不同的策略,他们在这项研究中探索了使用 CRISPR-Cas13d 工具(通过切割 RNA 而不是 DNA)是否能够使 T 细胞中的基因表达发生可逆变化。
“我们关心的是如何让这些 T 细胞能够更持久地攻击肿瘤细胞。尽管现在已经开发出了很多基因编辑工具,但是它们的功能还有待进一步拓展和提升。”这篇论文的第一作者、斯坦福大学亓磊实验室的研究生 Victor Tieu 表示。
与 Cas9 有所不同,Cas13d 可以很容易地同时靶向多个基因,比如,他们在这项研究中证实了可以同时对人类 T 细胞进行 10 次编辑操作。
“RNA 可以看作是 DNA 的‘下一层’,所以我们在操作上其实并没有改变任何基因,但我们仍然能够实现基因表达的巨大变化,从而改变细胞的行为。”Victor Tieu 指出。
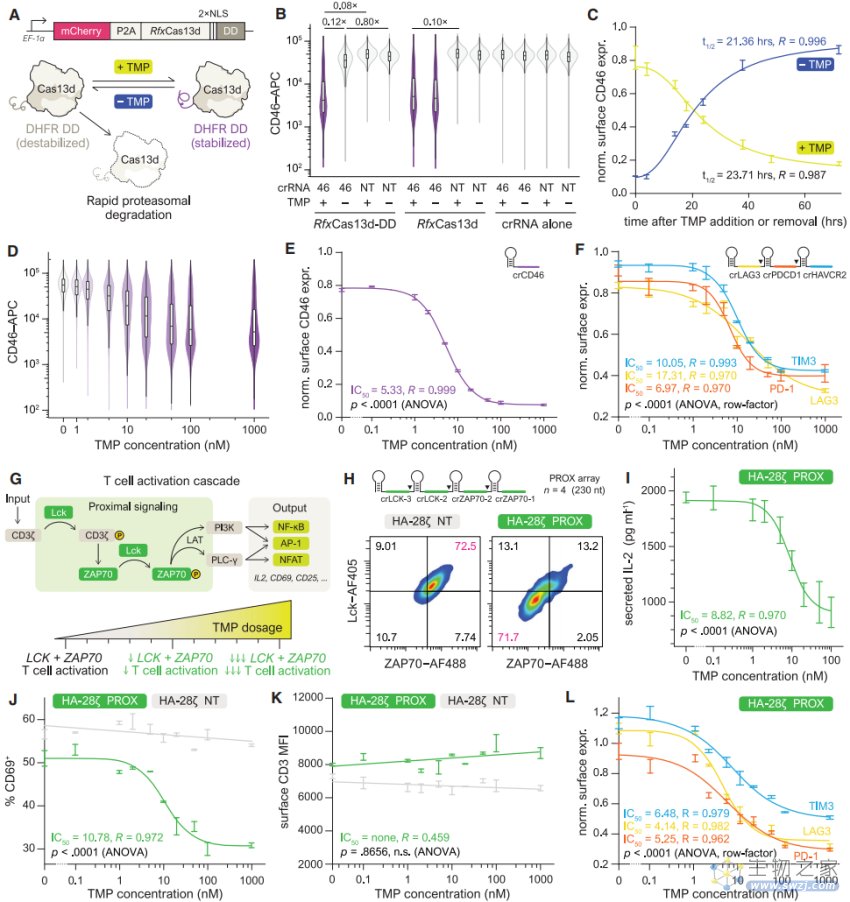
▲图|MEGA 工具可快速、定量和可逆地控制 T 细胞转录组(来源:Cell)
为了进一步验证这种新工具是否能成功改善 CAR-T 细胞功能,他们鉴定了 24 个可能与 T 细胞衰竭相关的基因,然后在培养基中测试了 6400 对基因组合,试验发现,使用 MEGA 工具将不同的基因关闭并确定新的基因组合,这些基因组合在增强抗肿瘤功能方面特别有效。
代谢调控把 T 细胞变成“耐力型马拉松选手”
研究至此并没有结束,在另一项试验中,亓磊和团队调整了 T 细胞中的一组代谢基因,让这些细胞具备杀灭肿瘤的持久耐力。类似于让 T 细胞从“短跑运动员”转变成为“马拉松运动员”。
然后,他们在体内(癌症小鼠模型)和体外(实验室培养的肿瘤细胞),将这些处理过的 MEGA-CAR-T 细胞与常规 T 细胞和 CAR-T 细胞进行了对比,并在三周后测试肿瘤生长情况和 T 细胞的存活情况。
他们发现,随着时间的推移,常规 T 细胞和 CAR-T 细胞逐渐消耗殆尽,而 MEGA-CAR-T 细胞虽然起初的抗肿瘤活性较为滞后,但一段时间后这些细胞依然具有持久的抗肿瘤活性,最终,这些细胞使肿瘤生长减少以及 T 细胞增殖提高了 10 倍。
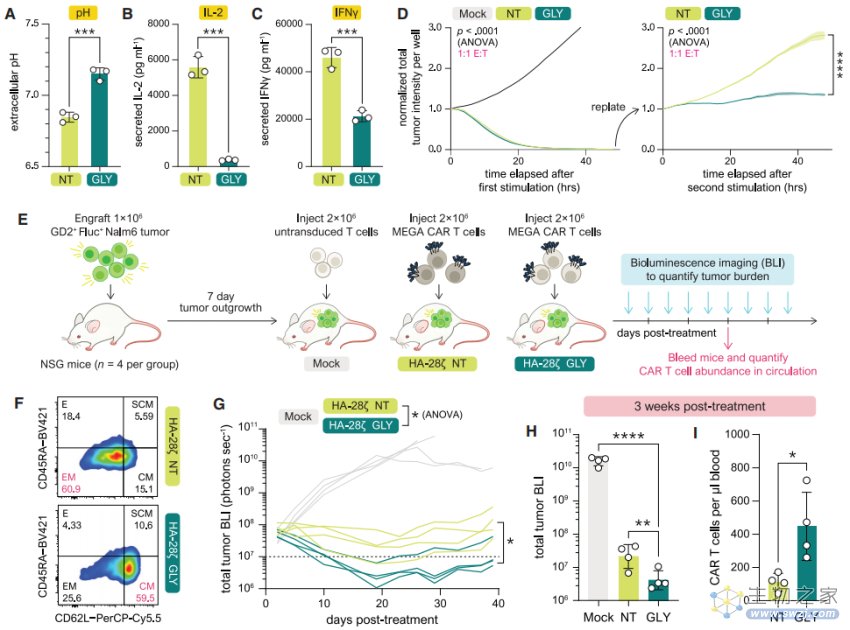
▲图|破坏糖酵解增强了 MEGA-CAR-T 细胞在体内/外的抗肿瘤活性(来源:Cell)
机制层面,关键在于他们使用 MEGA 工具改变了细胞对糖的消耗方式,从快速燃烧的糖酵解过程转变为有利于氧化磷酸化。
“我们利用这种新工具在 T 细胞内设计糖代谢途径中的 mRNA,以调节它们选择使用哪种糖分子,因此我们能够维持这些 T 细胞的持久性,让这些 T 细胞可以在肿瘤部位存活更长时间,更好的发挥抗肿瘤功能。”亓磊指出。
MEGA 工具不仅可以对调控 T 细胞代谢的基因进行微调,还可以用药物来进行调控。他们在研究中发现,当加入一种名为“甲氧苄啶”的抗生素时,它会引起 RNA 的变化,抑制细胞的糖酵解代谢,进而让这些细胞成为攻击肿瘤的“耐力型马拉松选手”,而当这种抗生素消失后,这些细胞便恢复到其原始基因表达。
“通俗来讲,这种基于抗生素药物的控制机制,类似于是为免疫细胞疗法的治疗设置了一个‘安全开关’。”这篇论文的共同通讯作者、斯坦福大学儿科和医学教授 Crystal Mackall 说道。

▲图|主要研究人员左起亓磊、Crystal Mackall 和 Victor Tieu(来源:Stanford University)
研究人员表示,虽然这种新开发的 MEGA 平台目前仍处于早期研究阶段,但有望在未来能够真正用于临床,并计划接下来朝着这个目标对该平台进行深入开发。
“我们希望能把这项技术推进到实际的临床应用中,我认为它有很大的潜力以前所未有的方式真正改变未来 CAR-T 细胞疗法的治疗格局。”Victor Tieu 说道。
参考链接:
1.https://doi.org/10.1016/j.cell.2024.01.035
2.https://news.stanford.edu/2024/02/21/new-rna-editing-tool-enhance-cancer-treatment/review/
3.https://med.stanford.edu/qilab/personnel.html
4.https://www.med.stanford.edu/profiles/crystal-mackall
5.https://www.innovatorsunder35.com/the-list/stanley-qi/
6.https://www.med.stanford.edu/profiles/crystal-mackall































