该项研究推进了人类对辐射损伤遗传机制的了解。同时,该文作者强调,社会应额外加强对男性辐射防护的关注度。尤其对于备孕期的男性,应避免接触包括辐射在内的任何致突变物质,并且受损的精子应避免用于人工授精。
电离辐射(以下简称“辐射”)是一种存在于自然界的短波高能射线。自从1895年伦琴意外发现X-射线,人工辐射便开始被广泛应用于工业与医学界,为这些领域带来了革命性的创新。
然而,辐射带来的成就也伴随着巨大的代价。科学家发现,辐射可以直接造成DNA双链断裂并继而诱发癌症或细胞死亡。因此,国际原子能机构(IAEA)制定了严格的辐射防护安全标准,用以减少人群对辐射的暴露。
但是,由于辐射的广泛应用(如核电站和医用辐射),以及历史上数次严重的核事故(如切尔诺贝利事故和福岛核电站事故),至今仍有无数人生活在对辐射的恐惧和担忧之中。
人类对辐射的恐惧,一方面来自于辐射的“致病性”,另一方面则来自于它的“遗传性”。而后者,也是困扰辐射研究领域多年的一个悬而未决的难题。多项人类流行病学和遗传学的研究显示,没有明确证据指向辐射损伤可影响后代健康或导致后代携带更多突变[1]。然而动物实验却呈现了相反的结论,即亲代的辐射暴露会导致后代出现更高的癌症发病率和更多的新发突变(DNMs)[2]。由于人类的研究往往受限于样本量大小和研究手段的局限性,想了解辐射损伤是否可以遗传,则必须通过模式动物来探析辐射损伤遗传的分子机制。
近日,来自德国科隆衰老及衰老相关性疾病研究所(CECAD)及老龄化疾病基因组稳定性研究所(IGSAD)的王斯瑶博士(第一作者兼共同通讯作者)和Björn Schumacher教授(共同通讯作者)团队在Nature发表文章 [3],以创新的研究方式揭示了辐射所致DNA损伤的遗传机制,即辐射所致的父系DNA损伤通过组蛋白介导的修复抑制来遗传给后代。

作者以秀丽隐杆线虫(Caenorhabditis. elegans)作为模型发现,接受辐照的雄性线虫与未经辐照的雌性交配后会导致第三代后代(F2代)出现极高的死亡率。而相反,辐照后的雌性线虫与未辐照的雄性交配则不会影响第三代线虫的健康。
作者进而发现,只有成熟的精子接受辐照才会导致这种隔代损伤,而卵子或早期精子(精原细胞或精母细胞期)即便接受极高剂量的辐射,也不会产生类似的遗传损伤。这项发现间接解释了人类数据的争议性,即由于人类精子的生成周期非常短暂(仅为2个月),只有接受辐照后的短期内受孕才有可能造成后代的遗传损伤。
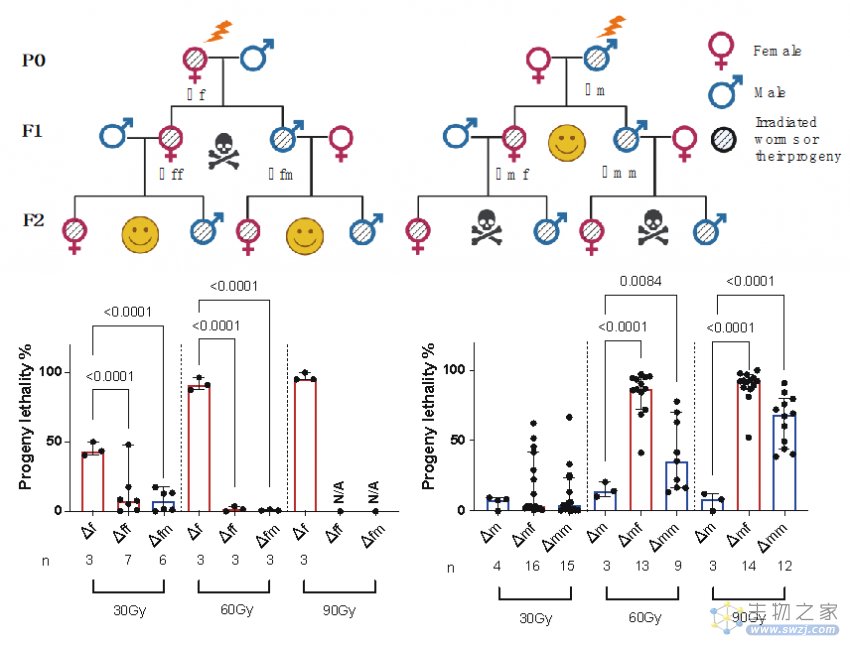
对雄性线虫的辐射损伤(Δm)造成第三代的高死亡率,而雌性线虫的辐射暴露(Δf)则不会
为理解辐射损伤的遗传机制,作者使用免疫荧光技术和荧光原位杂交技术检测到父亲辐照后的第二代线虫(F1代)里出现了一系列染色体异常现象,包括染色体融合和染色体碎片化。通过单线虫全基因组测序(WGS),作者在第二代线虫中检测出了升高的染色体易位现象,提示辐射损伤后的父系DNA碎片被错误的粘合到了一起。
为了找出是哪种错误的DNA修复方式导致了染色体易位,作者分析了染色体易位断点的DNA序列,发现这些断裂位点存在微同源序列(microhomology),意味着父亲辐射暴露导致的DNA断裂使用了一种易错的DNA修复机制:聚合酶θ介导的末端连接(TMEJ)。
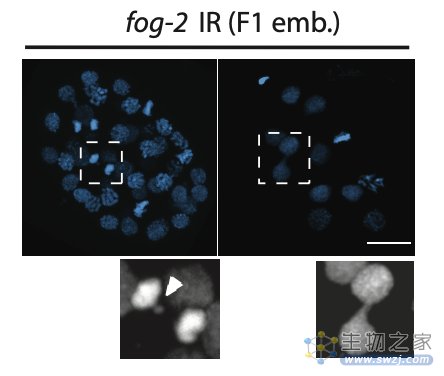
父亲辐照后的第二代线虫胚胎存在染色体异常
除了在线虫上的工作,作者也研究了该发现在其他物种中的保守性。通过对人类基因组数据的分析 [4],发现人类的父系DNA也广泛存在这种TMEJ介导的突变。
这说明,即便在未经辐照的状态下,其他原因造成的精子DNA损伤也可通过与线虫一样的方式遗传给后代。由此形成的突变,可能是物种遗传多样性的来源,也可能是导致各种人类遗传病的元凶。
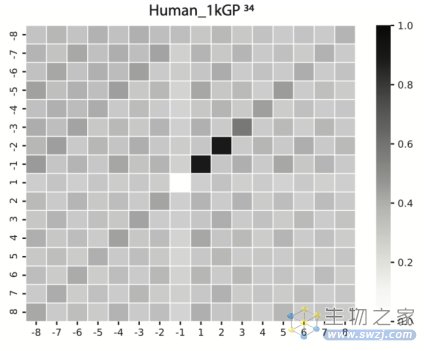
在人类基因组中检测到父系突变存在的微同源片段
最后,作者继续探究了父系辐射是如何导致第三代线虫的高死亡率。
通过使用SILAC定量蛋白组分析技术,作者发现父亲辐射后的第二代线虫的性腺表达了更多的组蛋白H1,并伴随着更高的异染色质化。这些组蛋白和异染色质蛋白将损伤的父系DNA紧密的包裹起来,使之逃避了严格的生殖细胞DNA修复机制,从而产生了大量无法存活的非整倍体胚胎。
通过使用RNA干扰技术敲除组蛋白或异染色质蛋白之后,可以显著提高生殖细胞的DNA修复精确度并明显改善F2代线虫的死亡率。
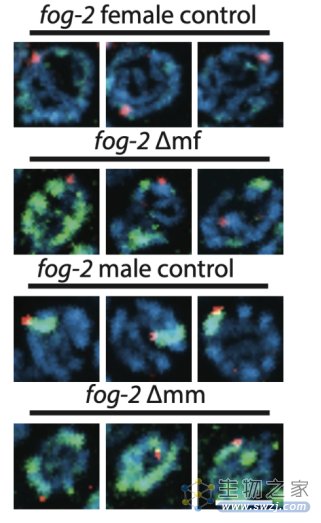
被异染色质包裹的生殖细胞DNA
总的来说,该项研究推进了人类对辐射损伤遗传机制的了解。同时,该文作者强调,社会应额外加强对男性辐射防护的关注度。尤其对于备孕期的男性,应避免接触包括辐射在内的任何致突变物质,并且受损的精子应避免用于人工授精。
参考文献:
[1]. Wakeford R. COMARE Seventeenth Report. Journal of Radiological Protection. 2017;37(1):319.
[2]. Brinkworth MH. Paternal transmission of genetic damage: findings in animals and humans. Int J Androl. 2000;23(3):123-135. doi:10.1046/j.1365-2605.2000.00222.x
[3]. Wang S, Meyer DH, Schumacher B. Inheritance of paternal DNA damage by histone-mediated repair restriction. Nature. Published online 2022:1-10.
[4]. Byrska-Bishop M, Evani US, Zhao X, et al. High Coverage Whole Genome Sequencing of the Expanded 1000 Genomes Project Cohort Including 602 Trios. SSRN Journal. Published online 2021. doi:10.2139/ssrn.3967671