阿尔茨海默病(AD),俗称的“老年痴呆症”,是最常见的神经退行性疾病。阿尔茨海默病患者通常表现为记忆力衰退、学习能力减弱、情绪调节障碍以及运动能力丧失等症状,患者生活难以自理,对家庭和社会造成巨大的负担。
从某种意义来说,阿尔茨海默病甚至比癌症还要可怕,其病因多样,且长期缺乏有效治疗药物,临床治疗通常只能延缓症状。更可怕的是,随着全球老龄化浪潮的加剧,阿尔茨海默病的发病率也在不断上升,预计到2050年,患者人数将增加至1.5亿。因此,阿尔茨海默病也被称为“21世纪的瘟疫”。
神经元丢失是阿尔茨海默病的一个决定性特征,但其潜在发生机制尚不清楚。
2023年9月14日,比利时VIB-KU鲁汶脑与疾病研究中心的 Bart De Strooper 团队在国际顶尖学术期刊 Science 上发表了题为:MEG3 activates necroptosis in human neuron xenografts modeling Alzheimer’ s disease 的研究论文。
该研究表明,在移植了人类或小鼠神经元的阿尔茨海默病小鼠模型的大脑中,只有人类神经元表现出严重的阿尔茨海默病病理,包括神经原纤维缠结和神经元坏死性凋亡。而长链非编码RNA-MEG3在阿尔茨海默病病变的人类神经元中被强烈上调,通过药理或遗传学手段下调MEG3,可挽救异种移植人类神经元中的神经元丢失。
这一发现揭示了人类神经元对阿尔茨海默病的独特易感性,并提示了阿尔茨海默病的潜在治疗靶点。

β-淀粉样蛋白(Aβ)斑块、神经原纤维缠结、颗粒空泡性神经变性(GVD)和神经元丢失是阿尔茨海默病的常见病理特征。阿尔茨海默病小鼠模型是研究阿尔茨海默病的经典动物模型,但这些动物模型通常是由人工诱导的,难以解释这些病理特征是如何相互关联的。
事实上,一直以来,关于Aβ病理是否可以诱导tau缠结以及神经元如何在阿尔茨海默病中死亡的基本问题仍然没有得到解答。有两种很好的模型可以复制阿尔茨海默病的人类病理特征——3D人脑类器官,以及在小鼠大脑中异种移植人类神经元。
在这项最新研究中,研究团队改进了先前基于Nod-SCID小鼠的异种移植模型,使用Rag2−/− (Rag2tm1.1Cgn) 免疫抑制遗传背景和单个AppNL-G-F (Apptm3.1Tcs/Apptm3.1Tcs) 敲入基因来驱动Aβ病理。研究团队将人类干细胞来源的神经祖细胞(NPCs)移植到这些含有Aβ的小鼠大脑中,两者整合良好并发育出神经元树突棘。移植两个月后,异种移植的神经元已经显示出一些成熟神经元标志物(NEUN、MAP2)和皮层标志物(CTIP2、SATB2、TBR1、CUX2)的特征。
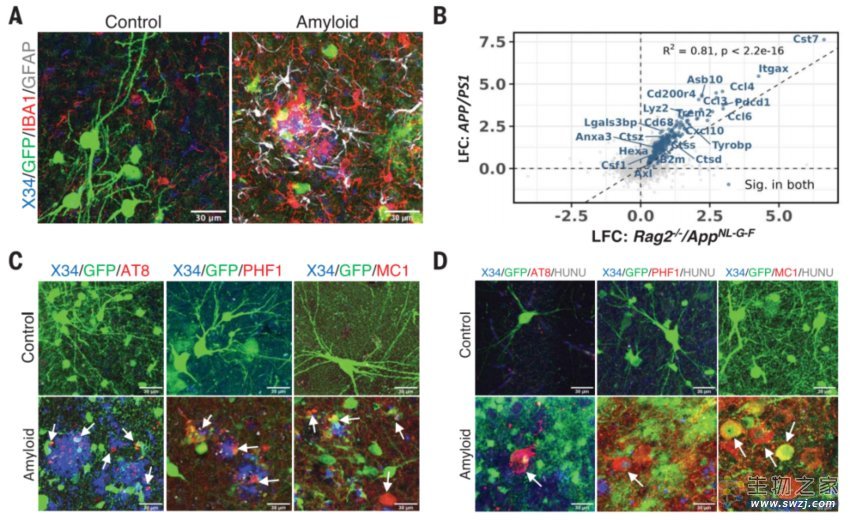
淀粉样斑块的沉积足以在异种移植动物模型中诱导缠结
与移植小鼠神经元的对照组相比,移植人类神经元的小鼠表现出严重的阿尔茨海默病病理,包括神经原纤维缠结、颗粒空泡性神经变性(GVD)、磷酸化tau蛋白血液生物标志物和相当大的神经元损失。这表明存在未知的人类特异性特征定义了人类神经元对Aβ病理的敏感性。
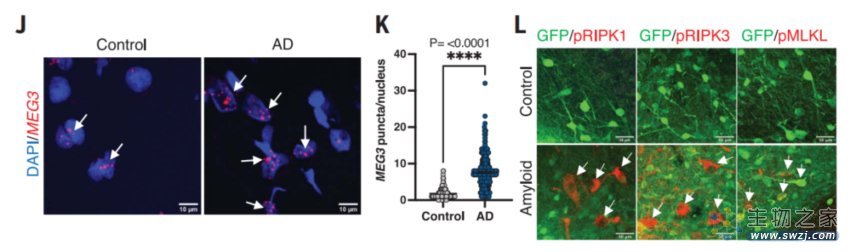
异种移植人类神经元表现出严重的阿尔茨海默病病理
转录组学分析显示,一种长链非编码RNA(lncRNA)——神经元特异性母源表达基因3(MEG3)在病变的人类神经元中被强烈上调了大约10倍。值得一提的是,这种神经元特异性长链非编码RNA在阿尔茨海默病患者中也有2-3倍的上调。
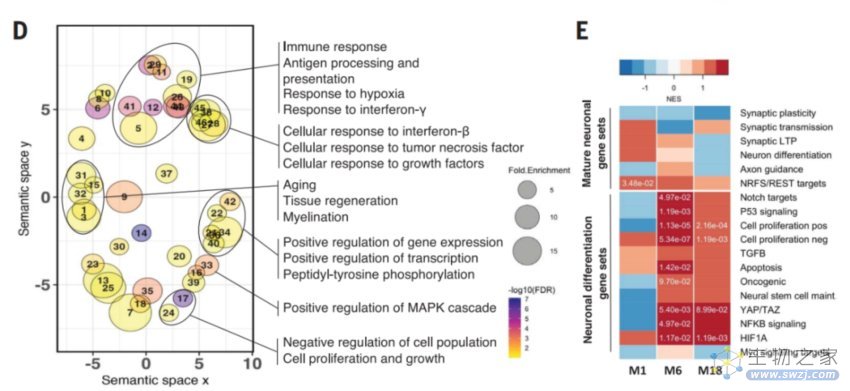
异种移植人类神经元的转录组变化
进一步研究表明,MEG3在体外过表达足以诱导人类神经元坏死性凋亡,而通过药理或基因操控受体相互作用蛋白激酶(RIPK1、RIPK3)或混合谱系激酶结构域样蛋白(MLKL)来下调MEG3,可以抑制人类神经元的坏死性凋亡,挽救异种移植动物模型中的神经元细胞损失。
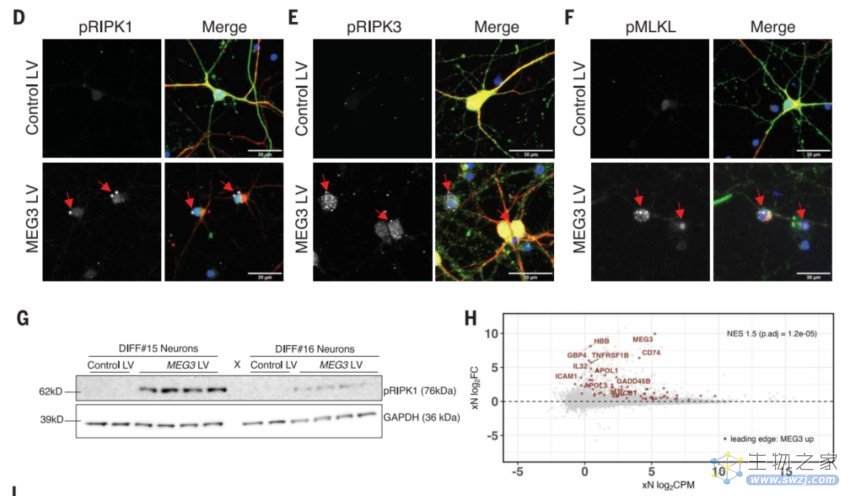
lncRNA-MEG3诱导人类神经元的坏死性凋亡
总而言之,这项发表于 Science 的最新研究表明,Aβ病理可以诱导人类神经元发生坏死性凋亡,而MEG3的急剧上调是其关键因素。因此,阿尔茨海默病的神经元丢失可以通过下调MEG3的表达或抑制坏死性凋亡途径来挽救,这也为阿尔茨海默病的防治带来了全新的潜在靶点和方法。
论文链接:
https://www.science.org/doi/10.1126/science.abp9556