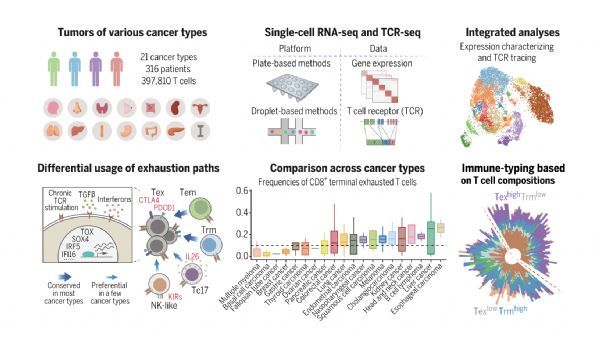
北京大学生物医学前沿创新中心(BIOPIC)、生命科学学院、北京未来基因诊断高精尖创新中心(ICG)张泽民课题组联合北京大学肿瘤医院季加孚、步召德课题组以及北京大学第三医院,在国际期刊Science上发表了题为“Pan-Cancer Single Cell Landscape of Tumor-Infiltrating T Cells”的研究论文。结合单细胞基因表达谱和T细胞受体序列,研究者系统地刻画了肿瘤浸润性T细胞的异质性和动态性,并系统地比较了癌症类型之间的异同。
T细胞是最关键的抗肿瘤免疫细胞,其中毒性T细胞是杀伤癌细胞的最主要细胞类群。肿瘤浸润T细胞中含有应答肿瘤抗原的T细胞。然而伴随着肿瘤发生发展过程,这些T细胞往往分化为功能失调状态,即T细胞耗竭。调节肿瘤浸润T细胞的治疗方法已经取得了显着的临床效果,但在不同癌症类型之间差异很大。越来越多的证据表明不同癌种的肿瘤微环境对塑造T细胞的组成和状态发挥着重要作用。单细胞转录组测序 (scRNA-seq) 已成功应用于多种癌症的肿瘤微环境的精细解析。例如,利用单细胞测序和生物信息技术,张泽民课题组及合作者之前曾对三个癌种,即肝癌、非小细胞肺癌和结直肠癌完成了单细胞水平的T细胞研究。但迄今为止仍然缺少对不同癌症类型的T细胞在单细胞水平进行系统比较分析。
该研究一共识别出17个CD8+T细胞类群和24个CD4+T细胞类群。癌、癌旁组织和外周血的T细胞组成具有明显的差异。特别是癌组织中出现了特有的耗竭CD8+T细胞,而TNFRSF9+Treg也在癌组织中高度富集。这些结果表明,肿瘤微环境明显地重塑了T细胞的状态。
该研究揭示了CD4+和CD8+T细胞亚群的异质性、分化路径以及转录调控。对于 CD8+ T 细胞,研究者揭示了T细胞耗竭的两种常见主要途径,即分别通过效应记忆T细胞和组织驻留T细胞这两种未耗竭状态。此外,KIR+类NK态T 细胞、TC17细胞或CD8+ Treg细胞均有可能转化为耗竭T细胞,但这些转化只在少数癌种中观察到。研究者进一步分析了T细胞耗竭相关的转录因子。TOX,PRDM1等已被报道的转录因子在大多数癌种的耗竭T细胞里高表达,但也有一些转录因子的表达呈现一定的癌种偏向性,如SOX4和FOXP3等。对于 CD4+ T 细胞,IFNG+ TFH/TH1 和TNFRSF9+ Treg是两群主要的潜在肿瘤响应T细胞。该研究推断IFNG+ TFH/TH1 细胞可能由经典的IL21+TFH分化而来。TNFRSF9+ Treg主要由其他Treg转化而来,但在少数癌种里TNFRSF9+ Treg可能从一些非Treg 细胞转化而来,如TH17和TFH。
该单细胞水平的泛癌种T细胞研究在多方面加深了人们对肿瘤浸润T细胞的认识,也将进一步促进新的癌症免疫治疗方法开发。































