AAV、慢病毒等载体是基因治疗领域最常使用的病毒载体,应用潜力也已经得到了一定的验证。然而,现阶段的这些病毒还存在无法有效特异性靶向组织和器官、递送尺寸等限制。
近日,美国天主教大学的研究人员提出了一种基于 T4 噬菌体设计制造人造病毒载体(T4-AVV)的方法。在研究中,科研团队通过设计和修饰 T4 噬菌体的特征结构组件构建 AVV,从 120 × 86 nm 衣壳开始,通过组装将 DNA、蛋白质、RNA 等多种生物分子组合结合在外壳的内部和外部,然后在纳米颗粒涂上阳离子脂质,使其能够有效进入人体细胞。
根据论文中的介绍,与现有技术相比,经过修饰的这类载体 AVV 具有更大的有效载荷容量和外表面,可以编程并递送治疗性分子。比方说,AVV 可以向机体递送更多 DNA 片段,大约可以递送 171 千碱基对的 DNA 片段,这是现有基因治疗递送载体的 20 倍。除了 DNA 片段后,载体还可以同时递送 1000 多种分子,包括蛋白质、RNA 等等。

(来源:Nature Communications)
该研究团队还进行了初步的概念验证,组装包裹基因组编辑、基因重组、基因替换、基因表达和基因沉默等基因片段和工具的 AVV 载体。
“基于噬菌体的 AVV 具有容纳体积更大、可定制、多种编辑等多种功能,有潜力变革基因疗法和个性化治疗,并提供更快、更安全、更经济的基因疗法。” 本文通讯作者 Venigalla Rao 说。
Venigalla Rao 是美国天主教大学噬菌体医学研究中心创始主任、细胞和分子生物学高级培训中心主任和生物学系教授。他的研究方向是病毒和噬菌体生物学,尤其专注于研究基于 T4 噬菌体病毒载体的治疗潜力。
01
设计人工病毒样颗粒,可递送更大片段 DNA
自在马里兰大学医学院从事博士后研究起,Venigalla Rao 专注于研究 T4 噬菌体及其治疗潜力已有 40 多年。
其实验室开发出了新型 T4 噬菌体平台,可将疫苗抗原和治疗性基因片段和基因编辑工具递送到人体细胞中。这一平台使用外衣壳蛋白 Hoc(高抗原性外衣壳蛋白)和 Soc(小外衣壳蛋白)作为接头,用病原体抗原修饰噬菌体衣壳,并通过 CRISPR 工程将治疗基因整合到噬菌体基因组中。
2019 年,Venigalla Rao 课题组开发出了一种基于 T4 噬菌体的新型生物疫苗双重功能疫苗,在动物模型中,可以预防炭疽和鼠疫。近期,还设计出了一种基于 T4 噬菌体的新冠疫苗,在小鼠模型中已经证明可全面保护感染新冠病毒 SARS CoV-2 的小鼠。
最新的研究建立在此前 T4 噬菌体研究工作的基础之上,Venigalla Rao 希望利用 T4 噬菌体设计出一种新型的递送载体并开发出“下一代”基因治疗。根据 Venigalla Rao 的说法,过去 30 年间,由于递送载体负载能力有限、工程化和细胞靶向性不足,以及存在安全性问题,生产这些疗法的过程非常复杂且昂贵,基因治疗领域进展并不大。基于我们对 T4 噬菌体的理解和研究证明,利用 T4 噬菌体避免这些技术限制和安全性问题、开发新型基因治疗是可行的。

▲图 | 从左到右 Wenzheng Guo, Xiaorong Wu, Rao, and Jingen Zhu(来源:美国天主教大学官网)
在本次的研究中,研究团队描述了一个 T4 噬菌体平台,这是一种大肠杆菌 T 系噬菌体,T4 噬菌体的感染效率接近 100%,每个复制周期为 20-30 分钟,是已知最有效的病毒之一。其头部是一个 120 × 86 nm 长的二十面体衣壳,T4 衣壳的表面排列着两种外衣壳蛋白 Soc 和 Hoc。
然后,利用 T4 噬菌体平台开发了一体化的载体构建方法,设计出了 T4-AVV。研究人员从包含三种必需衣壳蛋白 gp23*、gp24* 和 gp20 的空衣壳开始,然后将包括DNA、蛋白质、RNA 及其复合物的载荷分子(cargo molecule)层通过连续的组装过程将其整合到外壳的内部和外部。带负电荷的衣壳随后被带正电荷的脂质分子包裹,以此模拟这些病毒样纳米颗粒周围的包膜。组装好的人造病毒颗粒与天然病毒类似,具有脂质外壳、表面分子、衣壳和被包装的基因组和蛋白质。
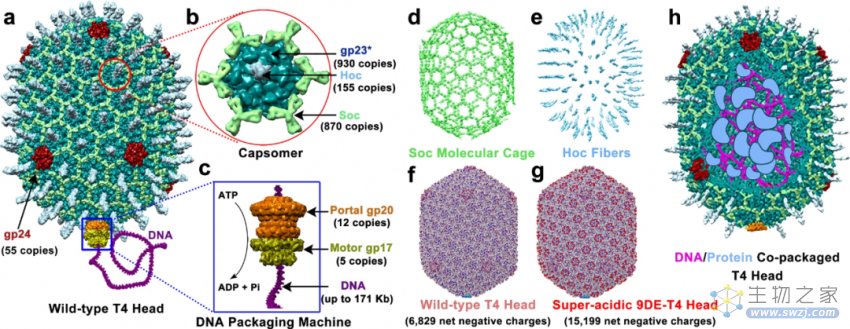
▲图 | 组装 T4 噬菌体-AVV 的结构成分(来源:上述论文)
论文中提到,T4 噬菌体是一种构建 AVV 非常理想的方式,基于 T4 构建的 AVV 也具有了这些优势。包括 T4 噬菌体的结构拥有稳定的衣壳和 1,025 个非必需分子的外表面,以及可容纳 171 千碱基对 DNA 片段以及 1000 个内部蛋白分子的容积。这些为包裹治疗性生物分子提供了充足的载物空间。
“我们首次表明 T4 噬菌体可以包裹在脂质中,这项创新可以使基因疗法顺利转移到人体细胞中。”
接下来,研究团队进行了概念验证,他们组装了包含基因组编辑、基因重组、基因替换、基因表达和基因沉默等有效载荷的 T4-AVV。一个 AVV 包含五种不同的组件,Cas9 基因组编辑核酸酶、Cre 重组酶、两个 gRNA、供体 DNA 和报告质粒。
试验显示,T4-AVV 能够有效将大片段有效载荷递送到人体细胞中。值得一提的是,在试验中,T4-AVV 还成功将全长抗肌萎缩蛋白基因导入人体细胞。抗肌萎缩蛋白基因是已知最大的人类基因之一,抗肌萎缩蛋白基因突变会导致杜兴氏肌营养不良症(DMD)。
研究人员还通过包装 40 Kbp 的 T7 噬菌体基因组 DNA 进一步证明了 T4-AVV 用于包装大片段 DNA 的潜力。
接下来,研究人员确定了 T4-AVV 可高效共同递送基因和蛋白质,这是 T4-AVV 的另一个关键优势,表明 T4-AVV 可以针对不同的应用定制有效载荷,开发定制化 AVV。“同时递送基因和蛋白质组合这一点可以编程 AVV,这种能力可用于在人类细胞中执行复杂的分子操作,有望将开启广泛的治疗应用。”
研究人员总结道,这些可编程的纳米衣壳可以同时包装超过 100 kb 的 DNA 片段、多种类型的 RNA 和多种蛋白质,并用于重塑和改写人类基因组。同时这种 T4-AVV 还具有生产成本低廉,转导效率高、产量高、稳定性强等优势。
02
计划 5 年内推进临床
随着噬菌体研究不断取得进展和突破,Venigalla Rao 团队也一直在推动这些研究成果从实验室走向临床治疗。他已经成立了噬菌体医学研究中心,为镰状细胞病、肌肉萎缩症和癌症等人类遗传疾病开发未来的疗法。
本次的成果是 Venigalla Rao 在基因治疗研究上取得的又一个重要突破。
他在新闻稿中提到,T4-AVV 是一种安全、有效的噬菌体基因疗法,具有极大的治疗潜力。我们的工具就像一种分子手术,可以安全、精确纠正缺陷并产生疗效,并有朝一日治愈多种难治性疾病。这是向扩大现有基因治疗领域迈出的重要一步,同时也为未来的治疗提供了新思路。
论文中进一步提到,这种可定制、即插即用的 T4-AVV 突破了现阶段将生物分子递送到人体细胞中的多种障碍。一是可以有效将多个相对较大的 DNA 片段递送到细胞中;二是可以实现多合一递送,可将 DNA、蛋白质、RNA 及其复合物,以及复杂复合物递送到细胞中;三是多重传输,通过整合载荷分子组装 T4-AVV,可以靶向多个位点,且还可以在基因组中进行多个分子操作;四是可编程性;五是通过重新连接纳米粒子增强 T4-AVV 的可编程性。

(来源:Quora)
Venigalla Rao 表示,尽管还需要做进一步的工作来评估其安全性,但这种方法有望在未来用于罕见病等多种难治性疾病的临床治疗中。
根据 Venigalla Rao 的说法,在 293 T 细胞等永生化细胞系中验证系统可行性之后,我们计划在原代人类细胞和人类胚胎干细胞,以及小鼠动物模型中验证系统的效果,尽快推进 T4-AVV 的临床试验。
不过,Venigalla Rao 也坦言,推进到下一阶段可能需要数百万美元,有了充足的资金之后,预计在五年内将这项技术应用于临床。
参考资料:
1.https://www.nature.com/articles/s41467-023-38364-1
2.https://communications.catholic.edu/news/2023/05/biology-professor-venigalla-rao-makes-breakthrough-on-gene-therapy-research.html
3.https://www.genengnews.com/topics/genome-editing/taming-t4-artificial-viral-vectors-deliver-big-payloads-into-human-cells/































