嵌合抗原受体(chimaeric antigen receptor, CAR) T治疗是工程化改造病人自己的T细胞使其选择性的靶向杀伤肿瘤细胞,其已经治愈了一些难治性的血液系统癌症。这些结果也鼓舞着人们把嵌合抗原受体CAR T治疗向包括实体瘤在内的整个肿瘤领域推进。同时,临床前以及临床数据也表明了CAR T疗法在肿瘤之外的治疗潜力,例如对自身免疫疾病,慢性感染,心脏纤维化,衰老相关疾病以及其它疾病的治疗。现在,新技术和新平台的发展也将会进一步拓展CAR T疗法在非肿瘤领域的应用。
近日,来自美国宾夕法尼亚大学的Carl H. June和Daniel J. Baker团队在Nature上发表了题为CAR T therapy beyond cancer: the evolution of a living drug 的观点文章,系统性的总结了CAR T设计的原理,当前在肿瘤治疗领域遇到的挑战,以及CAR T在非肿瘤疾病治疗的简要概括,和相关新兴技术的讨论。

CAR T治疗的原理和优势
CAR T治疗的原理就是将特异性抗体装备到具有杀伤性的T细胞上来精准的杀掉疾病细胞。CAR的单链可变片段具有靶向特异性,而胞内的信号转导结构域能够激活T细胞介导的细胞毒性。近年来人们利用一系列手段来精细改造CAR T使得其在不同环境下能发挥更好的效果。和传统治疗相比,CAR T细胞具有许多显著的优势。首先,CAR的内在特异性是现在所用的一系列小分子药物难以比拟的。其次,CAR T细胞利用了T细胞的细胞杀伤功能,这是一种相当高效的过程。还有,CAR T细胞是一种“活着的”药,一个CAR T细胞能够指数扩增并且杀死成千上万的靶标细胞。最后,CAR T疗法已经在临床上证明了其可行性。超过15000人接受了治疗,并没有观察到任何CAR T转化为恶性细胞的例子。在肿瘤这种疾病抗原负荷很高的情况下,CAR T依旧具有很好的安全性,因此将CAR T疗法应用于疾病抗原负荷更低的其他疾病中也是可行的且具有吸引力的。
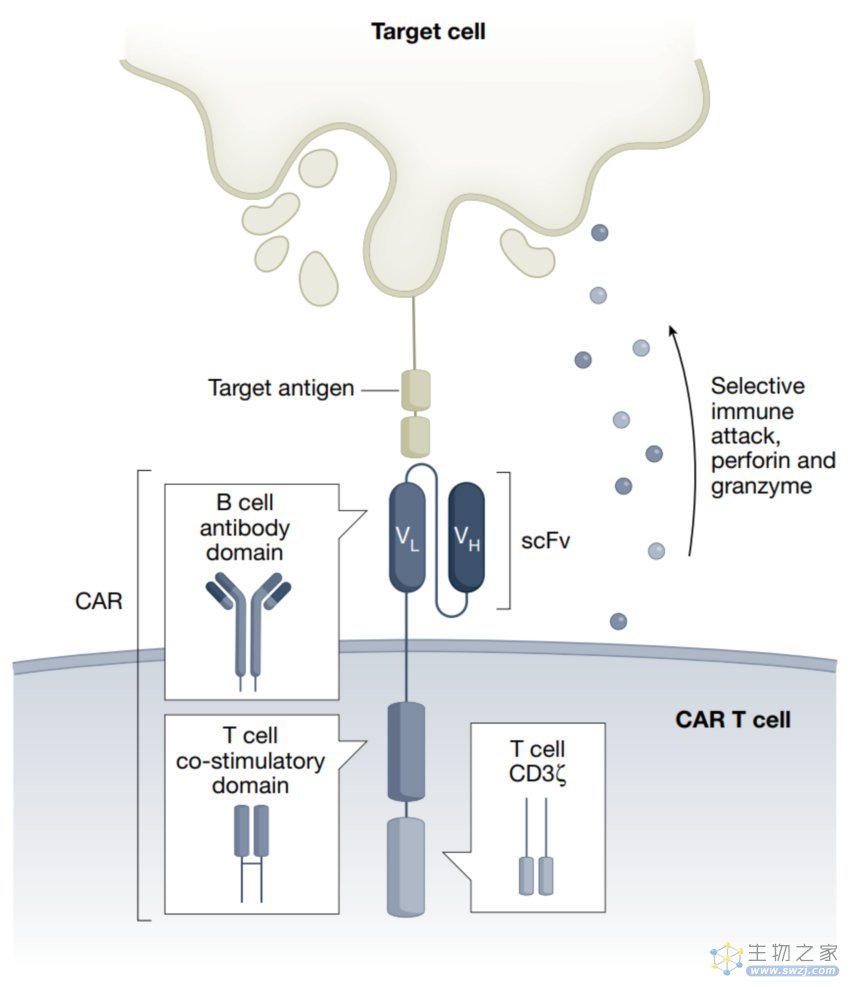
图1 CAR T设计的原理
理论上来说,CAR T治疗应用的两个原则是:其一,消除某特定一群的细胞是具有治疗作用的;其二,这群细胞是能够被特异性的靶向。这两个原则虽然看起来简单,但对许多疾病来说都是一个不小的限制。B细胞恶性肿瘤能很好的满足这两个要求,但对于其他多种肿瘤寻找到一个能够靶标的抗原是十分困难的。而最近的一些临床前以及临床试验表明CAR T治疗在自身免疫疾病,慢性感染,心力衰竭以及其他慢性疾病的治疗中有不错的潜力。
许多在实体瘤中面临的挑战在非肿瘤环境下变得不是那么显著了(图2)。首先,肿瘤细胞通常是非常多的,因此需要输入大量的CAR T细胞,而这往往伴随着高水平的细胞毒作用,会增加细胞因子释放综合征(cytokine release syndrome, CRS)以及非肿瘤的靶向毒性(on-target, off tumour toxicity)等不良反应发生的概率。相反,非肿瘤疾病通常拥有更少的靶标细胞群。此外,肿瘤治疗中,几乎全部的肿瘤细胞都需要被清除,然而在其他疾病中部分清除疾病细胞就可能会有治疗效果。肿瘤细胞往往具有较高的突变荷载会导致基因组的异质性,进一步会导致抗原的丢失,而在大多数慢性疾病中,突变载量和基因异质性都是相当低的。同样的,实体瘤肿瘤微环境的物理屏障阻碍以及免疫抑制性的微环境在许多慢性疾病中都是不存在的,免疫系统很容易靶向疾病组织。因此,和内在的免疫功能一起,利用一个合成的免疫方式来帮助清除病理性的细胞将是相当可行且有效的。
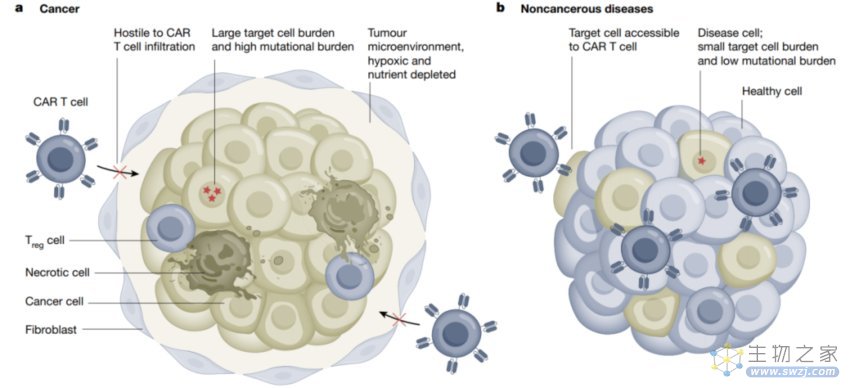
图2 和实体瘤相比,CAR T治疗在非肿瘤疾病中有不错的优势
CAR T细胞治疗在非肿瘤领域的应用探索
人们最先想到的扩展应用便是将已批准的CD19 CAR T细胞应用于B细胞引起的一些自身免疫疾病上。临床上已经有一些病例报道,将CD19 CAR T细胞用于治疗系统性红斑狼疮(systemic lupus erythematosus, SLE)。CAR T细胞在病人体内有良好的扩增,并能将B细胞很快的清除,缓解SLE的症状,病人也对CAR T也具有比较好的耐受,只出现了轻微的CRS。CD19 CAR T也被报道应用于治疗一例由于抗合成酶综合征引起的炎症性肌病患者上,病人接受CAR T回输之后疾病也得到了缓解。其他的一些策略还包括使用嵌合自身抗体受体,将自身病理性的抗原表位而不是单链可变片段融合到嵌合受体上,这样就可以选择性杀伤病理性的自身免疫B细胞而不杀伤其他B细胞,在临床前模型上也有不错的效果。但这一策略的关键在于寻找到病理性B细胞特异性的抗原表位和分子标志。最近也有报道,将CAR T细胞应用于治疗严重哮喘,在动物模型上,靶向嗜酸性细胞的CAR T细胞治疗能防止哮喘的发作。对于炎症性疾病,还有一种策略就是利用CAR将调节性T细胞Treg重新定向到炎症组织和器官,来缓解相应炎症,在临床前模型上也有一定的效果。
心脏纤维化也是一种严重的疾病,但很少有治疗直接靶向心脏纤维化,最近的临床前实验表明,靶向纤维化的CAR T细胞能够恢复心脏的功能。靶向纤维化的CAR T细胞也可应用于其他纤维化相关的慢性疾病。也有研究在寻找衰老相关的特异性抗原,尝试将CAR T细胞治疗应用于衰老相关疾病的治疗。同时靶向一些非人的抗原如一些病毒细菌真菌等的特异性抗原,在减缓CAR T在正常组织中靶向毒性的同时,或可以治疗这些感染性疾病。
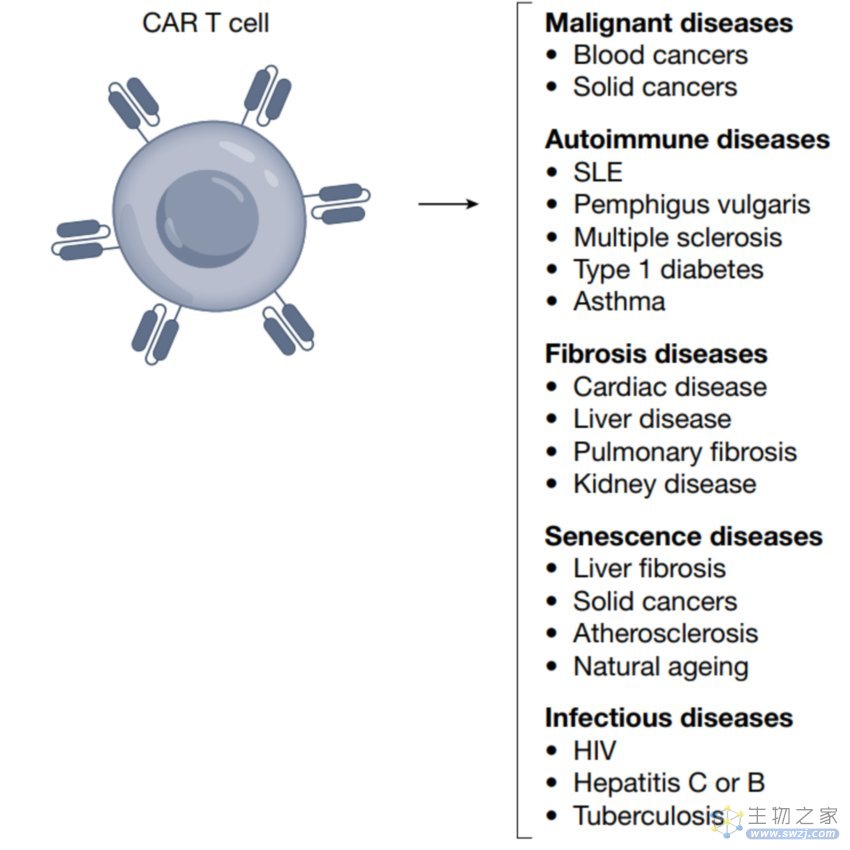
图3 CAR T细胞治疗在多种疾病中的应用
新兴技术平台
CAR T治疗在快速的迭代,不断的吸收新的技术。CRISPR介导的基因编辑也提高了CAR T细胞的功能。合成生物学的引入也能够帮助人们设计逻辑门控的CAR T细胞。同时将CAR应用于其他免疫细胞例如自然杀伤细胞,巨噬细胞,树突状细胞,B细胞和γδT细胞等策略,也正在火热研究中。
mRNA疫苗在COVID19中的成功实践,也吸引着人们将其应用于CAR T领域。许多临床试验都在开发具有靶向性的脂质纳米颗粒(targeted lipid nanoparticles, tLNPs)来特异性的递送mRNA,可以通过在脂质纳米颗粒表面锚定特异性抗体来实现其靶向细胞特异性。将CAR mRNA通过脂质纳米颗粒递送至T细胞已经在多个临床前研究被报道。这种策略,将减少体外制作扩增传统CAR T的繁琐步骤,将会大大减轻患者的等待和经济负担。CAR mRNA递送的另一个潜在优点是T细胞表达CAR是瞬时表达的。传统的CAR T细胞是持续性表达CAR,这在治疗肿瘤时或许是一个优点,但将CAR T治疗应用于其他非肿瘤疾病,持续性的清除并不是必须和期望的。例如,一过性的清除部分心脏纤维化便能大大改善心脏机能,然而持续性的抑制纤维化则可能影响正常的伤口修复等生理过程。
另外一种绕过体外制备CAR T细胞的方式是体内病毒感染,利用靶向病毒将CAR 基因特异性的递送到体内的T细胞内,或许也可以节约CAR T治疗的成本和可及性。但病毒的脱靶效应是一个值得重视和研究的副作用。还有一种就是利用同种异体捐赠者或者干细胞来源的CAR T细胞,制备备用型的CAR T细胞库也可用来节约成本和制造过程。
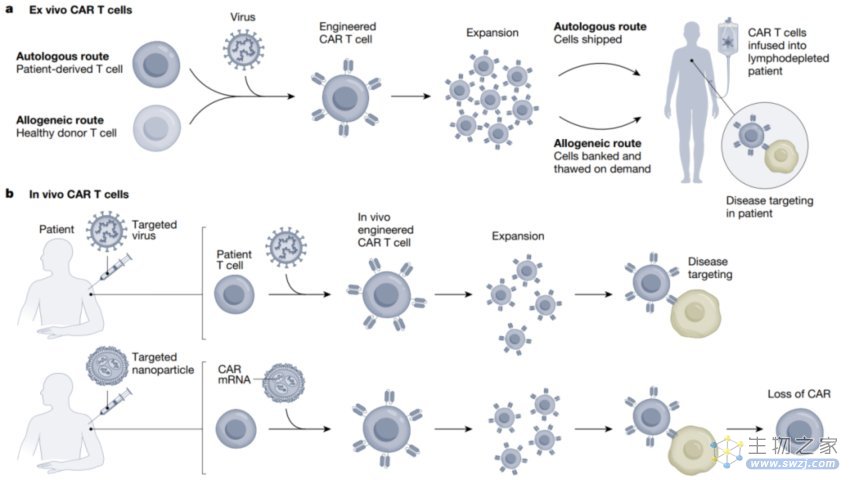
图 4 体外和体内不同的CART递送平台
CAR T治疗在治疗血液肿瘤上的成功使得其吸引了大量的关注。但在其他领域的CAR T疗法仍处于早期的发展阶段。作者在最后也强调了几点挑战。CAR T治疗的一个瓶颈就是发现可以靶向的抗原。急需发展新的技术和平台去发现新的疾病特异性的靶标抗原。另一个值得强调的问题就是细胞因子释放综合征,虽然在自身免疫疾病中由于靶标细胞载量较少,CRS可能不像肿瘤中那么强,但这仍需要更多的试验来继续探究。另一点就是CAR T对健康细胞的清除,mRNA介导的瞬时表达CAR T的策略或许可以减少这种不想要的副作用。相信不断迭代的新技术和新平台将会加速CAR的设计和递送,也会促进CAR T疗法在肿瘤以及肿瘤之外的更多的领域发挥其强大的作用。人们只是刚刚意识到CAR T细胞疗法这种“活药”的潜力。
原文链接:
https://doi.org/10.1038/s41586-023-06243-w































