免疫球蛋白的开发和临床应用为癌症疗法带来了希望,单克隆抗体作为癌症靶向治疗药物,以其特异性高,血清半衰期长,亲和度高,免疫效应功能强著称。截止2021年,全球的抗体肿瘤市场就增长到460亿美元,随着大量新的治疗方法的临床开发,2026年这一数值预计将进一步增至800亿美元。
2023年2月20日,来自悉尼加文医学研究所的Daniel Christ在Nature Cancer上发表了题为Advances in antibody-based therapy in oncology的综述,概述了领域的主要进展,尤其关注于最近新涌现的工程抗体候选物,讨论其分子结构和作用机制,为临床开发和实践提供信息。

人类抗体的分子组分
主要有5种不同的类型,分别是IgG (~80%), IgA (~10%), IgM (~5%), IgD (<1%) and IgE (<1%),其中IgG1和IgG4是最常用治疗的。人IgG分子约150kDa,包含两个重链和两个轻链,重链可变区调节与抗原的互作,恒定区调节效应器的结构和免疫作用,轻链可变区调节与抗原互作,恒定区调节二硫键的的联系。单克隆抗体的组织渗透性较低,血清半衰期较长,用于单克隆抗体药物优化的分子工程主要是进一步延长其血清半衰期以及增强亲和性和效应功能及免疫原性。
作用机制
单克隆抗体涉及的机制非常广泛,从简单的阻碍激活到天然免疫反应的增强。抗体可与受体或配体竞争性结合,从而阻断配体——受体相互作用,其中受体阻断是单克隆抗体曲妥单抗和西妥昔单抗的作用机制,配体阻断则是贝伐单抗的主要机制。另一种策略是直接靶向目的细胞,如2型单克隆抗体具有对靶细胞的直接毒性。随着研究进展,科学家们逐渐发现免疫效应器功能在治疗中的重要性,通过调节抗体Fc与γ受体的相互作用实现调节效应器的功能从而成为主流。除了通过抗体免疫直接杀伤肿瘤细胞外,我们还可以通过调节免疫检查点来激活免疫,这就催生了免疫检查点抑制剂的使用,比如针对CTLA-4和PD1/PD-L1靶点的单克隆抗体,但实际应用于临床还需要能准确识别其协同效应的临床前模型。
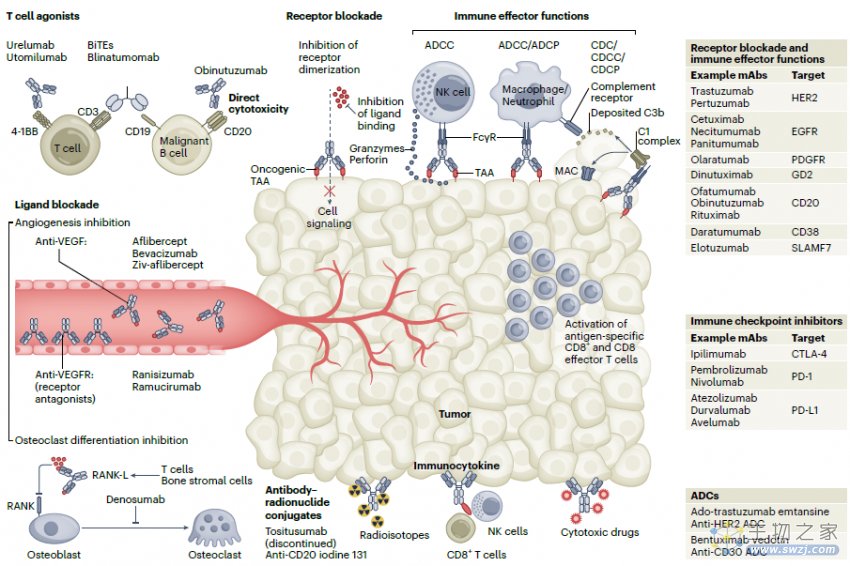
图1 肿瘤中抗体疗法的靶点和作用机制
免疫受体激动剂
一个通过免疫检查点抑制剂来诱导T细胞激活从而提高抗肿瘤应答的方式是激动性抗体的使用,与其广泛的前景不同,它的开发充满了挑战。首先从蛋白质工程角度,识别能够引发激动信号的单克隆抗体需要很多额外的考量(结合的方向等),其次需要避免过度激活免疫细胞而产生的毒性,这就要求剂量合适,作用机制安全。
抗体——药物耦合
将抗体的靶向能力与小分子的抗肿瘤活性结合的耦合物(ADCs)逐渐成为病人护理中关键的选择,ADCs包括直接靶向肿瘤抗原的抗体和负载的抗肿瘤剂,其结合在癌细胞表面,通过溶酶体内化及蛋白水解作用释放毒性。治疗实体瘤和血液肿瘤的ADC靶点特征不同,前者多为细胞表面过表达的蛋白,以实现快速的内化,后者则是谱系特异的靶点,对正常上皮组织毒性较小。批准的ADCs携带的负载主要有3种机理,分别是诱导DNA双链断裂,抑制微管和抑制拓扑异构酶,我们需要根据药物特性和肿瘤生物学进行选择。除这种毒性外,负载物还可能激活免疫应答,引发免疫性细胞死亡。
此外,对于ADCs而言,将小分子装在至抗体上的连接剂(linker)也很重要,最近的研究表明工程化的半胱氨酸或非天然氨基酸的应用可以实现特异性耦合,提升耦合效率,稳定性和治疗能力。linkers分为两种,cleavable linkers和non-cleavable linkers,前者依赖于蛋白水解酶,具有膜渗透性和旁观者活性,后者是在溶酶体内降解,旁观者活性得以被限制。
ADCs与其他癌症疗法的联用能够以往治疗方法的不足,找到灵敏度和抗性的标记物,优化治疗指标,克服治疗抗性。
抗体片段,双特异性T细胞接合物和TCR模拟物
抗体片段最关键的应用就是携带细胞毒性或放疗活性药物以及在双特异性T细胞接合物(BiTEs)中充当携带者。BiTEs作为T细胞与癌症靶向细胞沟通的桥梁,会通过靶向TCR的抗体片段雇佣T细胞,形成一个人工免疫突触,促进T细胞调节的靶细胞杀伤。一个BiTE包括结合至靶细胞CD19的scFv和结合至T细胞CD3的scFv,随着技术的进展,大量可替代的分子形式逐渐走入临床,比如将Fc结构域与基础BiTE融合,能够延长其半衰期和性价比。TCR模拟抗体的发展使得与其他多肽交叉反应活性成为可能,但具有高水平的亲和性和特异性的TCR模拟抗体的开发依然还存在很大挑战。
放疗免疫耦合物
放疗免疫耦合物(Radioimmunoconjugates, RICs)是一类新出现的癌症靶向药物,与传统的化疗不同,RICs是应用靶向药物进行全身放射治疗,与ADCs类似,靶向药物可以是完整的抗体,也可以是其衍生物,如多肽或小分子配体,与ADCs不同的是,RICs共轭的部分是一种螯合剂而不是一种连接剂,能够非共价捕获放射性核素。常用的两类放射性核素是α粒子和β粒子发射体,两者各有优劣,后者递送的能量较低,二者都在临床上有很好地应用。RICs靶点的选择非常重要,这决定了能否选择性递送化疗至癌细胞而不影响其他健康器官及组织。与ADCs一样,放射活性装载的选择最好考虑以下几个因素,包括目标抗原谱(例如患病率、肿瘤细胞密度和肿瘤与健康组织的表达)、肿瘤微环境和肿瘤生物学。
糖基化,细胞因子武装和可激活抗体
抗体结构的变化有助于拓宽临床应用,最常见的工程改变就是调节Fc区域的糖基化模式,新的遗传工程手段如CRISPR–Cas9编辑的出现能够实现Fc区域的点突变,带来了除糖基化外的改变,产生了很多特异性的变体,影响药物代谢动力学,增强单抗隆抗体的亲和性。
可替代的方式
非IgG类型的单抗隆抗体正逐渐被应用于治疗,尽管都具有一定的应用前景,但临床和商业化的使用还需要工程化的介入以延长半衰期和增强适应性。单克隆抗体免疫激活组分在临床前试验中已经展现出对瘤内CD8+ T细胞和NK细胞的积累和活化,一些抗体——细胞因子的融合物也已经进入临床试验。
距离第一个用于癌症治疗的单克隆抗体——利妥昔单抗(rituximab)问世已经过去25年,肿瘤领域的抗体疗法已逐渐成熟。尽管很长一段时间内,领域的主流都是IgG同型抗体,如今,高度工程化的变体如抗体片段,ADCs等逐渐涌现,未来同时靶向多个细胞机制的联合策略会成为必需,工程化抗体与小分子药物或放疗的联用将带来肿瘤学进展的变革。
原文链接:https://doi.org/10.1038/s43018-023-00516-z































