肺癌是全世界癌症相关死亡人数最多的疾病。近年来,分子检测和免疫组织化学技术的迅速发展,进一步开创了肺癌个体化治疗的时代。罕见的肺癌亚群约占10%,每种都表现出不同的临床特征。罕见肺癌的治疗主要基于常见肺癌的证据,考虑到肿瘤间的异质性,这可能导致不可靠的临床益处。随着对罕见肺癌分子图谱知识的不断增加,靶向基因变异和免疫检查点成为一种强有力的治疗策略。此外,细胞疗法已成为靶向肿瘤细胞的一种有前景的方法。在本综述中,首先讨论了针对罕见肺癌的靶向治疗和临床前模型的现状,并通过整合现有队列的结果提供突变谱。最后,指出了罕见肺癌靶向药物的开发面临的挑战和未来发展方向。
背景
肺癌是美国和全世界癌症相关死亡的主要原因,约占癌症相关死亡人数的五分之一。非小细胞肺癌(NSCLC)在所有肺癌中占比最大,占84.3%,其次是小细胞肺癌(SCLC),占12.5%。NSCLC在组织学上可进一步分为常见类型,包括腺癌(50.4%)和鳞状癌(22.6%),以及罕见类型,例如大细胞癌、腺鳞癌和肉瘤样癌。根据欧洲罕见癌症监测(RARECARE)项目,每10万人中发生罕见癌症的人数不到6人。NSCLC的每种罕见组织学亚型不仅满足罕见癌症的阈值,而且满足罕见的发生率(5%临界值)(表1)。但这些罕见的亚型总共约占所有原发性肺癌的十分之一(图1A)每年可能影响超过20多万人,造成了不可避免的疾病负担。
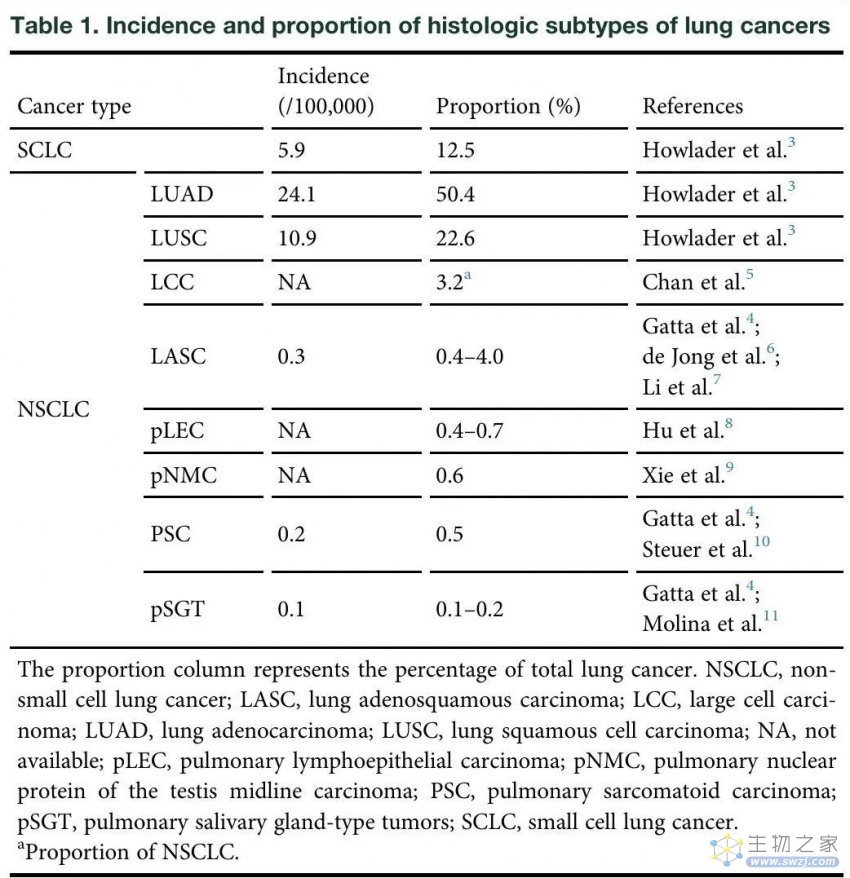
表1 肺癌组织学亚型的发生率和比例
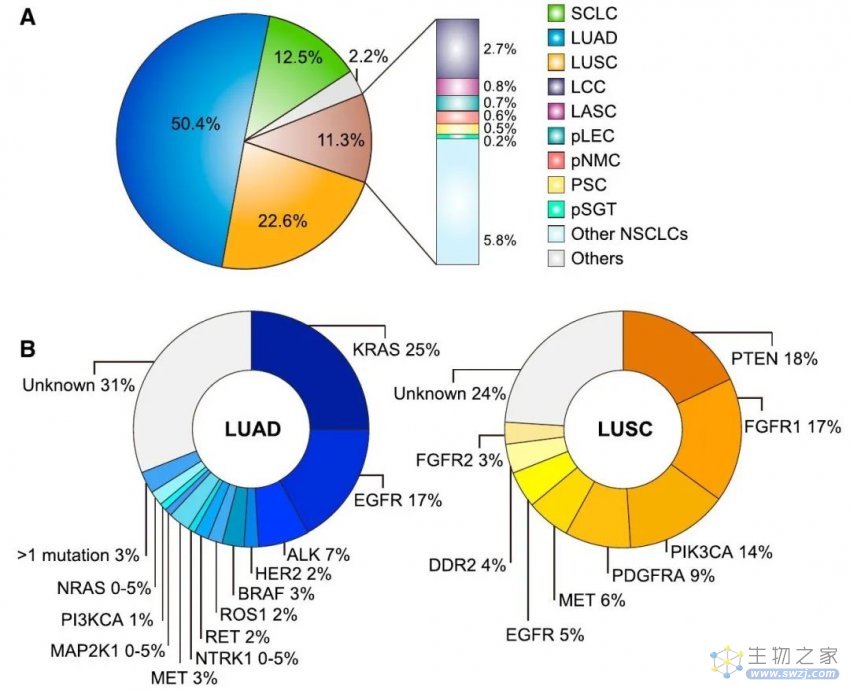

图1 所有肺癌的组织学亚型概述和NSCLC主要亚型的突变谱 (A)所有肺癌的组织学亚型。 (B)LUAD和LUSC驱动突变的频率。
虽然手术是肺癌的最佳治疗方法,但超过一半的患者(54%的NSCLC,75%的SCLC)在诊断时已发生远处转移,5年生存率不佳(NSCLC为26.3%,SCLC为6.7%)。靶向SCLC一直具有挑战性,RB1和TP53缺失是其主要的驱动基因突变。近几十年来,随着在肺腺癌(LUAD)和肺鳞状细胞癌(LUSC)中检测到驱动基因突变(图1B),越来越多的靶向药物已成为肺癌患者更有效和持久的治疗选择。就罕见肺癌而言,在没有标准治疗的情况下,治疗方法通常遵循常见NSCLC的指南,这可能导致临床反应不理想。幸运的是,蓬勃发展的基因测序和免疫组织化学技术揭示了许多罕见肺癌的独特分子景观,从而实现了更精确的分子分类和新的治疗策略。例如Pécuchet等人,根据突变特征将肺肉瘤样癌(PSC)分为两组(Csig4和Csig2-3-13),发现PD-L1高表达与Csig4相关,而MET突变和其他靶点在Csig2-3-13中更常见。尽管针对罕见肺癌特定亚型的靶向治疗取得了一些有希望的结果,例如针对PSC的间充质上皮转化因子(MET)抑制剂,但靶向治疗在许多罕见肺癌中的价值仍不清楚。需要进一步的研究来充分了解这种方法对罕见肺癌患者的潜在益处和局限性。
本综述在简要描述了所涉及罕见肺癌的临床特征后,总结了美国食品药品监督管理局(FDA)批准的靶向药物的临床疗效,并探索靶向其他分子和肿瘤细胞的潜力。此外,考虑到其在验证致癌机制和药物筛选方面的重要作用,还介绍了临床前模型现状。最后,指出了发展罕见肺癌靶向治疗的挑战和前景。
组织病理学和流行病学特征
大细胞癌
大细胞癌 (LCC),见于约 3.2% 的非小细胞肺癌中,只有在切除肿瘤后,排除小细胞癌、腺癌或鳞状细胞癌的任何明确的形态学或免疫组织化学检测后,才能被诊断出来。手术可以为LCC患者带来显著的益处,而化疗或放疗的疗效有限。超过70%的LCC患者在III/IV 期被发现,远处转移倾向也表明其预后比其他亚型NSCLC更差。
肺腺鳞癌
肺腺鳞癌(LASC)是一种含有LUAD和LUSC成分的混合型肿瘤(每种成分至少占肿瘤的10%),占所有肺癌的0.4%-4.0%。根据两种成分的比例,LASC可分为三组:腺型ASC(LUAD>60%),鳞状型ASC(LUSC >60%)和结构平衡型ASC(每个成分在40%-60%之间)。LASC多见于有吸烟史的老年男性,与LUAD和LUSC相比,具有更强的侵袭性特征和较差的预后。
肺淋巴上皮癌
肺淋巴上皮癌(肺LEC),见于不到1%的肺癌,与EB病毒(EBV)感染密切相关,目前被归类为LUSC的一种亚型。病理学表现为基质中大量的淋巴细胞和浆细胞的强烈浸润,可见瘤内淀粉样蛋白沉积和鳞状分化。患者多为亚洲人,平均年龄51-57岁,无明显的性别倾向。大约一半的患者在早期被诊断出来,并有机会接受手术,因此肺LEC的5年生存率高于其他亚型NSCLC。然而,考虑到其独特的分子特征,值得探索更精确的治疗方法。
肺睾丸核蛋白中线癌
肺睾丸核蛋白(NUT)中线癌(肺NMC),仅占肺恶性肿瘤的0.6%,是一种由NUT重排定义的低分化和侵袭性癌症。组织病理学特征主要为低分化细胞伴局灶性鳞状分化,免疫组织化学染色NUT表达呈阳性。肺NMC好发于青壮年,平均年龄为42-48岁。大多数情况下,晚期肺NMC患者接受化疗或放化疗后,无明显获益。肺NMC预后极差,中位总生存期为2.2-2.75个月。
肺肉瘤样癌
肺肉瘤样癌(PSC),占所有肺癌的0.5%,是一组异质性肿瘤,包括5个亚型,分别为多形性癌(PC)、梭形细胞癌、巨细胞癌、癌肉瘤和肺母细胞瘤。PC是最常见的亚型,主要由上皮癌和至少10%的肉瘤样成分(梭形或巨细胞)组成。PSC具有高侵袭性的特点,48.0%–69.2%的患者被诊断为IV期,其对常规全身治疗的耐药性可能是生存结局较差的原因之一。
肺原发涎腺型肿瘤
肺原发涎腺型肿瘤(肺SGT)仅占所有肺癌的0.1%-0.2%,代表了一组独特的异质性NSCLC,包括黏液表皮样癌(MEC),腺样囊性癌(ACC)和4种罕见亚型。肺MEC主要由黏液细胞、鳞状细胞和中间细胞组成,而肺ACC主要由上皮和肌上皮细胞组成,常表现为黏膜下扩散和神经周围浸润,肺SGT患者年龄分布较广,以中年为主,无明显性别倾向。大多数肺SGTs被认为是低级别肿瘤,具有侵袭性弱和生存期长的特点。肺MEC的死亡率高于肺ACC,复发率则相反。
FDA批准的靶向药物治疗
罕见肺癌没有标准治疗方法,也很少被纳入靶向治疗的临床试验(表2),主要是由于单一疾病的罕见性。鉴于罕见肺癌被归类为NSCLC,在临床实践中,检测那些可匹配的靶向治疗相关的生物标志物可能更加切实可行,从而使患者受益。
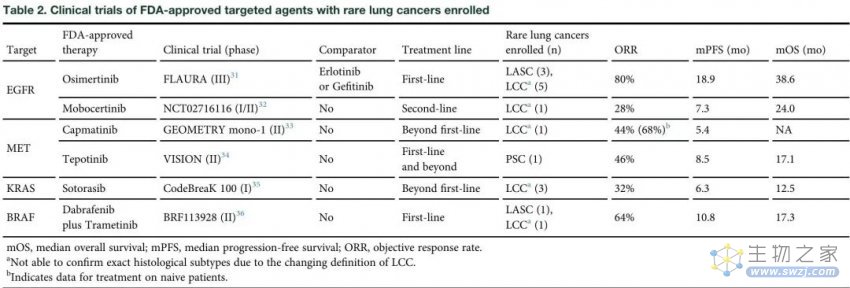
表 2.FDA批准的靶向药物治疗罕见肺癌的临床试验
美国FDA批准的NSCLC治疗靶点包括表皮生长因子受体(EGFR)、间充质上皮转化因子第14外显子(METex14)跳跃突变、Kristen大鼠肉瘤病毒癌基因同源物(KRAS)点突变、血管内皮生长因子(VEGF)突变、BRAF V600E点突变、间变性淋巴瘤激酶(ALK)融合、ROS原癌基因1受体酪氨酸激酶(ROS1)基因融合、神经营养因子酪氨酸激酶(NTRK)基因融合、RET重排、以及免疫检查点。
罕见肺癌中经常报道的靶点概述
在罕见肺癌中报道较多的靶点包括EGFR、MET、KRAS、VEGF和免疫检查点(图2A)。
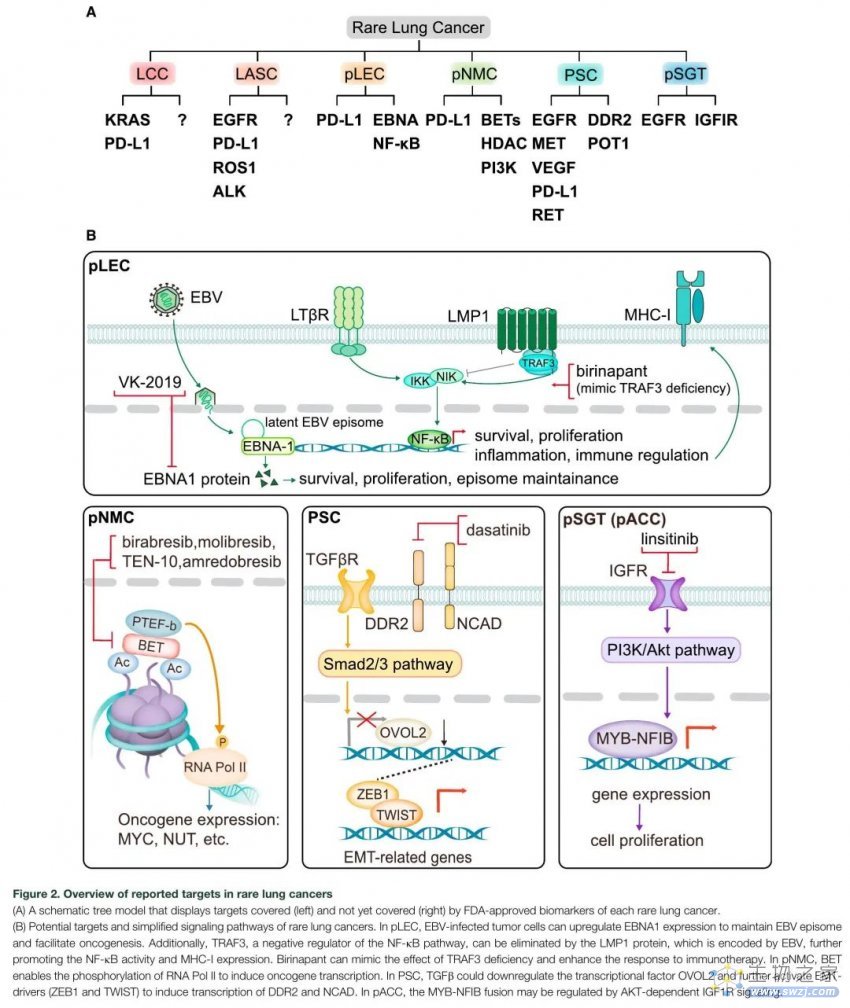
图2 罕见肺癌中已报道的靶点概述
EGFR基因编码受体酪氨酸激酶(RTKs)的HER/erbB家族的跨膜蛋白。EGFR突变可能引发细胞内信号级联,导致肿瘤增殖、转移、血管生成和凋亡抑制,从而进一步导致不良的临床结局。多代EGFR酪氨酸激酶抑制剂(TKIs)已被开发并获得FDA批准,对NSCLC患者显示出极大的临床益处。
MET 变异可以表现为第14号外显子跳跃突变,基因拷贝数扩增,蛋白过表达,MET基因融合等。具体而言,METex14跳跃突变是导致过度激活酪氨酸激酶信号的主要事件。在过去几年中,针对METex14跳跃突变的药物研发取得了巨大进展,包括基于不同结合模式的Ⅰ型(例如卡马替尼和赛沃替尼)和Ⅱ型(例如卡博替尼和Glesatinib[格来替尼])抑制剂。包括谷美替尼和Vebreltinib(伯瑞替尼)在内的新药已被FDA批准为“孤儿药”,并且两者均正在进行Ⅱ期临床试验(分别为NCT04270591和NCT03175224)。MET扩增通常被认为是对EGFR-TKIs和ALK抑制剂的耐药机制,近年来受到越来越多的关注。
KRAS基因是RAS 基因家族(包括HRAS,KRAS和NRAS)中突变频率最高的亚群,其编码的KRAS蛋白可介导肿瘤细胞的增殖,凋亡和分化。近年来,G12C突变促进了靶向药物的开发,FDA批准索托雷塞(AMG510)和Adagrasib(阿达格拉西布)(MRTX849)用于治疗携带KRAS G12C突变的NSCLC患者。
VEGF基因位于6号染色体上,编码一种VEGF蛋白,通过与酪氨酸激酶受体VEGFR相互作用,在血管生成和内皮细胞分化中起关键作用 。贝伐珠单抗和雷莫芦单抗,分别是针对VEGF和VEGFR的单克隆抗体(mAbs),已被FDA批准用于治疗NSCLC。安罗替尼和阿帕替尼等多靶点TKIs正在进行临床试验评估。与精准靶向治疗不同,血管生成是癌症的标志之一,因此抗血管生成药物可以在不伴有特定VEGF基因突变的情况下应用。
免疫检查点是指在T细胞上传递抑制性信号的一组分子,如PD-1、CTLA-4、TIM3、LAG3和TIGIT等。免疫检查点抑制剂已被证明可有效激活免疫细胞活性达到抗肿瘤目的,最成功的临床实践是抑制PD-1/PD-L1通路和CTLA-4,已有几种免疫检查点抑制剂(ICIs)被批准用于NSCLC。此外,一项Ⅱ期开放标签的研究试验,目的是在既往接受过治疗的罕见组织学亚型晚期NSCLC患者中,探讨阿替利珠单抗的抗肿瘤活性和安全性(表3)。
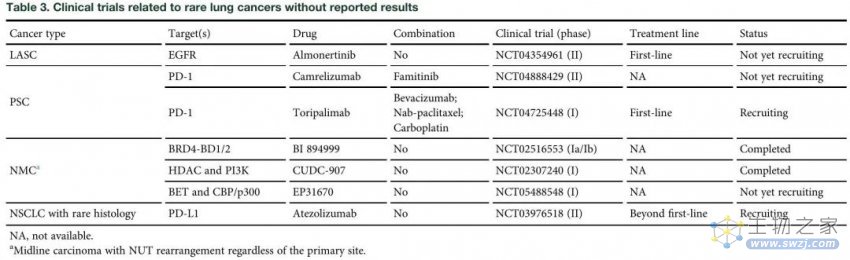
表 3.罕见肺癌相关的临床试验未报告结果
大细胞癌
在12.0%–31.6%的LCCs中检测到KRAS突变,以G12C突变为主,约52%的LCCs在RTK/RAS/RAF通路发生变异。一项单组、Ⅱ期临床试验在既往接受过铂类化疗(联合或不联合免疫治疗)的NSCLC患者(包括3例LCC患者)中研究了索托雷塞作为后续治疗的抗肿瘤活性。客观缓解率(ORR)为37.1%,中位无进展生存期(PFS)为6.8个月,然而,LCC患者的反应尚不清楚,因为结果未根据组织学类型进行分析。
LCC患者(≥1%)PD-L1表达率为44.4%–80.0%,其中27.8%–40.0%患者有≥50%的肿瘤细胞染色。帕博利珠单抗联合化疗的一项Ⅲ期临床试验纳入了5例LCC患者。虽然未根据组织学亚型进行分析,但免疫检查点抑制剂可能对LCC患者有益。
肺腺鳞癌
LASC患者EGFR突变率为11.0%–55.4%,东亚人群(21.9%–55.4%)高于西方人群(11%–13%)。此外,EGFR突变在年轻女性和非吸烟者中更为常见。虽然表现为双相性肿瘤,但主要突变基因在LASC的LUAD和LUSC成分间无明显差异。EGFR被认为是在LASC中常见的基因变异之一。因此,EGFR-TKIs可能是有前景的治疗选择。Song等人回顾性分析了49例接受吉非替尼或厄洛替尼治疗的中国LASC患者,发现携带EGFR突变型患者的中位PFS明显长于野生型组(8.7个月vs2.1个月)。几项回顾性分析还报告了第一代EGFR-TKIs治疗EGFR突变型LASC患者的相似结局,中位PFS为9.3–12个月,ORR范围为33.3%–56.6%。然而,不可避免地会出现对这些药物的获得性耐药。在Hu等人的队列研究中,8例患者(42.1%)在初始治疗进展后发生EGFR T790M突变,使用第三代EGFR-TKI奥希替尼获得显著缓解,中位PFS为10.2个月。奥希替尼对第一代TKI耐药(其中约一半归因于T790M突变)产生的良好治疗效果也在另一个队列中出现。目前,一项随机Ⅱ期临床试验(NCT04354961)正在进行中,旨在评估阿美替尼(第三代EGFR-TKI)与化疗作为LASC患者的一线治疗的效果。
在39.2%–70.6%的LASC患者中检测到PD-L1表达,且在鳞状成分高于腺体成分,而ICIs治疗LASC患者的疗效鲜有报道。一项回顾性研究显示,患者基于ICI的治疗获得了显著缓解,ORR为28%,中位PFS为6.0个月,总生存期(OS)为 24.7个月,单药ICI组和化疗联合ICI组之间无显著差异。
其他靶标,如ROS1融合和EML4-ALK融合,也已被确定。Wang等人在124例LASC患者中发现8例存在ALK融合,其中6例伴EML4-ALK融合,4例伴ROS1融合。1例携带EML4-ALK重排的LASC患者在新辅助化疗失败后使用塞瑞替尼作为新辅助治疗,获得部分缓解,提示TKI作为新辅助治疗在具有可靶向变异的LASC患者中具有潜在应用价值。此外,Cheng等人报道了首例携带CD74-ROS1融合的LASC患者,二线治疗使用克唑替尼获得有效治疗,其PFS达到了4个月。
肺淋巴上皮癌
肺LEC缺乏可靶向的驱动基因,如EGFR,KRAS,ALK,ROS1和BRAF等。不幸的是,即使在携带EGFR致敏突变的患者中,接受EGFR- TKI也几乎无法达到1个月的PFS,因此提示发生其他致癌驱动因素。
肺LEC PD-L1阳性率高,为61.7%-91.5%,间质中大量细胞毒性T淋巴细胞和浆细胞浸润,提示免疫治疗的潜在价值。Xiao等人在肺LEC患者中开展了第一项关于一线免疫治疗联合或不联合化疗的回顾性研究,结果表明免疫治疗的疗效优于化疗(中位PFS为11.0个月vs 中位PFS为6.9个月),化学免疫治疗可能是最佳一线治疗。
肺睾丸核蛋白中线癌
最近的一项针对下一代测序(NGS)研究表明,肺NMC很少发生经典致癌基因(如EGFR、KRAS、BRAF)的突变,SNVs是主要的突变类型。这些结果表明,体细胞突变很大程度上是乘客事件,在肺NMC中抑制这些靶点的疗效鲜有报道。
ICIs的PD-L1表达状态和疗效主要通过病例报告呈现,综合考虑,二线治疗使用ICIs可能进一步延长生存期。此外,考虑到在卵巢癌和B细胞淋巴瘤中,溴结构域和末端外结构域(BET)抑制剂(BETis)可以调节PD-L1的表达,BETis联合ICIs治疗可能在肺NMC中产生协同作用。
肺肉瘤样癌
在5.0%-22.6%的PSC患者中发现EGFR突变。Liu等人认为EGFR敏感突变是PSC的主干突变之一,尽管肿瘤内具有高度异质性(ITH)。值得注意的是,中国PSC患者携带EGFR致敏突变的可能性较高,而大多数白种人患者携带罕见EGFR突变(例如外显子2、18或20),这提示存在种族差异。 因不同队列中的突变率相对较低且存在差异,故EGFR-TKIs在PSC患者中的疗效鲜有报道。Zou等人报道了1例晚期PSC患者在确诊EGFR L858R突变转移后,接受厄洛替尼治疗,PFS为6个月。
在2%–31.8%的PSS患者中检测到METex14跳跃突变,检出率高于其他NSCLC亚型。对METex14阳性肺癌患者(包括PSC患者)进行的几项回顾性研究报告,一线使用克唑替尼(一种覆盖MET的多靶点TKI)治疗使患者达到部分缓解。此外,特泊替尼(一种高度选择性MET-TKI)的一项开放标签的Ⅱ期临床试验,纳入了152例患者,其中有2例PSC患者,ORR为46%,中位缓解持续时间为11.1个月。然而,上述结果均未通过组织学分析。赛沃替尼(是一种Ib型c-MET抑制剂)在一项多中心,单臂,开放标签的Ⅱ期研究中进行了探索,该研究纳入70例METex14阳性NSCLC患者,其中包括25例PSC患者。赛沃替尼在PSC患者中显示出良好的抗肿瘤活性,ORR为40.0%,中位PFS为5.5个月,使其在中国被批准用于治疗NSCLC。在1例METex14阳性PSC病例中,患者在达到36周的PFS后,对赛沃替尼产生了获得性耐药,这可能是因为出现了EGFR、KRAS和FGFR1扩增。
MET扩增在PSC中报道较少,其频率从4.8%到13.6%不等。1例携带EGFR L858R突变伴MET扩增的PSC患者接受第一代EGFR-TKI (吉非替尼)和MET抑制剂(克唑替尼)联合治疗后,维持了9.7个月的疾病稳定。2020年,He等人报道了首例使用第二代EGFR-TKI阿法替尼联合克唑替尼治疗携带罕见EGFR突变和二次MET扩增的PSC患者,PFS为4个月。目前,一项临床试验(NCT05015608)旨在评估赛沃替尼联合奥希替尼治疗与化疗相比,对一线EGFR抑制剂治疗失败后,伴MET扩增的局部晚期或转移性NSCLC患者的疗效。因此,有必要对这些突变之间的相互作用进行更多的研究,多靶点联合治疗可能会解决单药治疗的不足。
在14.6%–39.0%的PSC患者中发现了KRAS突变,目前既没有回顾性研究,也没有前瞻性研究。值得注意的是,据报道KRAS突变与TMB和PD-L1表达呈正相关(p = 0.031)。KRAS突变患者对帕博利珠单抗的缓解率较高。
在5.6%的PSC患者中检测出VEGF变异。在PSC主要亚型PC的另一队列中,许多患者(15/75)显示VEGF高表达,VEGF高表达与较差的预后显著相关。同样,Vieira等人认为血管浸润是PSC的主要组织学特征之一。研究表明,免疫系统重编程与血管正常化之间的相互调节可提高疗效。例如,1例晚期PSC患者接受安罗替尼联合纳武利尤单抗作为三线治疗后显示出部分缓解。在另一例PD-L1表达阴性的晚期PSC患者中,阿替利珠单抗、贝伐珠单抗、卡铂和紫杉醇(ABCP)联合治疗使肿瘤明显缩小,并且在阿替利珠单抗和贝伐珠单抗维持治疗期间观察到肿瘤继续缩小。据报道,其他联合治疗(包括安罗替尼+替雷珠单抗或信迪利单抗)也有效果。
PD-L1 表达阳性常见于PSC(45.0%–90.2%)。许多回顾性研究和零星个案病例报道证实了免疫治疗对PSC 患者有益,且肿瘤 PD-L1高表达似乎与免疫治疗的更好应答相关。例如,Lee等人报道了49例接受ICI单药治疗(主要作为二线治疗)的肺PC患者,其ORR为49.0%,中位PFS为7.2个月,PD-L1表达与OS呈正相关(p = 0.001)。在另一项队列中,无论PD-L1状态如何,二线ICI治疗均证实其良好的疗效。越来越多的研究已将免疫疗法纳入NSCLC的一线治疗中。Qian等人研究显示在PSC患者中,一线ICI联合抗血管生成治疗,获得了57.1%的部分缓解率,中位PFS为9.2个月。考虑到协同作用,两项正在进行中的临床试验旨在评估ICI和抗血管生成疗法的联合治疗(表3)。最近,一项真实世界研究显示,ICI联合化疗的一线治疗可使患者达到73.8%的ORR和10.3个月的中位PFS。基于一线免疫治疗良好的结果,一项临床试验(ChiCTR2000031478)已启动,在晚期PSC患者中测试卡瑞利珠单抗联合化疗的一线治疗。此外,对于EGFR-TKIs或MET-TKIs治疗失败的PSC患者,化学免疫治疗可能对其有效。据GU等人报道,1例 METex14 阳性 PSC 患者获得克唑替尼耐药后,使用纳武利尤单抗联合化疗达到显著缓解,PFS为15 个月。此外,同步抑制PD-1/PD-L1和CTLA-4在晚期NSCLC的一线治疗中显示出良好的抗肿瘤效果(NCT02542293)。类似地,一项非随机、开放标签的Ⅱ期临床试验评估了度伐利尤单抗(抗PD-L1)联合替西木单抗(Tremelimumab)(抗CTLA-4)治疗复发性或转移性PSC患者的疗效,中位PFS为5.9个月,OS为15.4个月。
在少数病例中发现了其他变异,包括AKT1-E17K突变,BRAF V600E突变,ALK融合,RET融合和NTRK突变。WU等人报告了首例携带KIF5B-RET基因融合的PSC患者,经选择性RET抑制剂普拉替尼治疗后达到部分缓解。
肺原发涎腺型肿瘤
在以策划者样转录辅激活因子2 (MAML2)重排为特征的肺MEC中,EGFR突变的发生率较低,但在亚洲人群中较高。EGFR-TKIs在携带EGFR L858R突变的肺MEC患者中显示出抗肿瘤活性。有趣的是,对于未携带EGFR致敏突变的患者病例,体外数据显示MAML2重排可能预测吉非替尼在NSCLC细胞系中的抗肿瘤活性。相应的,EGFR-TKI治疗EGFR 野生型肺MEC患者也显示出部分缓解。在肺ACC患者中,未发现BRAF,PIK3CA,ALK,DDR2和PDGFRA基因突变,而少数携带EGFR突变的患者对EGFR-TKIs表现出良好的反应,例如获得了较长的PFS(19个月)或疾病控制。
潜在目标
基因检测技术的发展促进了对罕见肺癌基因组谱的探索,进一步加深了对肿瘤发生机制的理解,并有助于潜在靶点的发现。首先,肺LEC和肺NMC缺乏可靶向的驱动基因。其次,靶向在肿瘤发生中起辅助作用的分子或信号通路与其他治疗方法联合应用可能具有价值。因此,以下潜在靶点值得讨论,尽管匹配的靶向药物在罕见肺癌中的研究较少(图2B)。
肺淋巴上皮癌
·EB病毒(EBV)蛋白
与其他NSCLC亚型相比,EB病毒在肺LEC癌变中起着关键作用。最近,Wu等人首次概述了来源于肺LEC的EB病毒基因组图谱,其与鼻咽癌非常相似。超过半数(22/32)与肺LEC风险相关的变异位于EBV编码的小RNA (EBER)区域,可能通过改变EBER2的二级结构影响EBV的致病性。围绕基因 BILF2、BWRF1、BARF1 和 BALF5 发现的其他变异可能与EBV肺上皮的恶性转化能力有关。值得注意的是,病毒-宿主整合在肺LEC中很少发生(5.1%),只有4个整合断点位于细胞基因内,这些事件可能会促进癌变。此外,载脂蛋白B mRNA 编辑酶催化多肽样(APOBEC)突变特征可能在EBV感染过程中发生,促使肺LEC的癌变。大多数T细胞表位变化分布在潜在基因区域(例如LMPs和EBNAs)。
基于肺LEC和鼻咽癌(NPC)的基因组图谱相似性,在NPC中开发的治疗方法也可能为肺LEC患者带来益处。例如,抑制EBNA1蛋白的DNA结合能力能够抑制异种移植物模型中EBV阳性肿瘤的生长。EBNA1靶向药物(例如VK-2019)已进入EBV阳性NPC患者的临床试验(NCT04925544)。靶向EBV抗原的细胞毒性T淋巴细胞,如潜伏膜蛋白(LMPs),是NPC的一种替代治疗方案,可能进一步有益于其他EBV相关的恶性肿瘤,例如肺LEC。
·NF-κB 信号通路
转录因子核因子-κB(NF-κB)是Rel家族的一种转录因子,可被介导先天性免疫和适应性免疫的经典和非经典信号通路选择性激活。NF-κB信号通路的异常会影响参与细胞增殖、转移和抑制细胞凋亡的基因,进而促进肿瘤的发生。
NF-κB信号通路在13.2%-30%的肺LEC中被激活。发现NF-κB通路的多个负调节因子失活,例如TRAF3,NFKBIA,CYLD,NLRC5和TNFAIP3,TRAF3的缺失被认为是NF-κB失调的核心因素。上述LMPs也可以作为NF-κB通路的基本激活剂。具体来说,TRAF3是编码TNF家族关键转导蛋白的基因,通过NF-κB信号通路调节MHC-I的表达。虽然目前没有靶向TRAF3的药物,但模拟TRAF3敲除效应的药物,如Birinapant(比瑞那帕),被证明在黑色素瘤小鼠模型中可以增强对ICI的应答。
肺睾丸核蛋白中线癌
·表观遗传调控因子
肺NMC主要由BRD3/4-NUT融合驱动。具体来说,BET家族的丝氨酸激酶BRD4通过其溴结构域与染色质结合,NUT募集p300/CBP来驱动致癌基因(如MYC)的转录,从而进一步阻断NMC细胞的分化。NUT还与更罕见的对应基因(如NSD3、ZNF532或CHRM5)融合,最终这些基因倾向于与BRD4相互作用,从而产生类似的致癌作用。因此,BET抑制剂(BETi)被认为可以拮抗NUT融合诱导的MYC上调。Stathis等人提供了抗NMC的BETi Birabresib(比拉瑞塞) (MK-8628/OTX015)的首例临床证据。在接受Birabresib(一种靶向BRD2、BRD3和BRD4的合成小分子)治疗的4例患者中,2例肺NMC患者获得了显著的长期生存(分别为19个月和18个月)。随后,另一个接受Birabresib治疗的NMC队列显示疾病控制率为75%(6/8),因为该组报告了所有实现PR的患者,故其确定了推荐的Ⅱ期剂量(RP2D)为80mg,每日一次。然而,考虑到BET蛋白在基础转录机制中的重要性,BETis不可避免地会引起剂量限制性毒性(DLT),例如血小板减少症和中性粒细胞减少症,从而促使选择性BETis的发展,以尽量减少副作用并维持疗效。例如,选择性 BETis,包括Molibresi/GSK525762和RO6870810/TEN-010,使肺NMC患者获得显著疗效和延长生存期。几项正在进行的NMC临床试验正在评估其他BET抑制剂疗效(表2)。此外,组蛋白去乙酰化酶(HDACs)对BRD4与启动子相结合至关重要,因此,抑制HDACs可能会破坏这种修饰。
·PI3K/AKT 信号通路
磷脂酰肌醇3-激酶(PI3K)/AKT通路是癌症中变化最多的通路之一,控制着多种生物学过程,包括生存、代谢和转移。PI3K/AKT信号通路在肺癌耐药中起重要作用,相应的抑制剂如MK-2206可增强TKI在厄洛替尼耐药NSCLC中的活性。迄今为止,已经开发出许多靶向PI3K/AKT信号通路的药物。
体细胞突变可导致多条通路功能障碍,尤其是PI3K/AKT信号通路。Xie等人发现60%(6/10)的肺NMC在PI3K/AKT通路中存在非同义突变,如PIK3CA、PIK3R1、PTEN和ERBB4。既往在NUT癌细胞中,小干扰RNA筛选将PIK3CA鉴定为阳性。CUDC-907是一种HDAC/PI3K双抑制剂,在一项纳入NMC患者的Ⅰ期临床试验(NCT02307240)中进行了评估。
肺肉瘤样癌
·上皮-间充质转化
在这些罕见的肺癌中,PSC细胞可能来源于上皮-间充质转化(EMT),即上皮细胞失去其细胞极性和细胞间黏附,获得侵袭性转化为间质细胞的过程。PSCs上皮成分和肉瘤样成分的差异表达基因富集于EMT相关通路。同样,之前的研究证实了转化生长因子(TGF)β介导的PSCs EMT的重要作用,并证明OVOL2抑制是EMT过程中的一个特定特征。此外,ALK和MET共扩增似乎通过募集SRC和FAK通路促进PSCs的EMT。在TP53和PTEN基因联合缺失的PSC临床前小鼠模型中,EMT过程被基因组和转录组图谱证实。抑制EMT可抑制肉瘤样细胞增殖,逆转EMT介导的EGFR抑制剂耐药。Manzotti等人提供了肉瘤样H1299细胞系对达沙替尼敏感的初步证据,达沙替尼是一种可抑制EMT的广谱TKI。
·端粒保护蛋白1
端粒保护蛋白1(POT1)基因是端粒家族的成员,编码一种参与端粒维持的蛋白质。在28.0% - 33.3%的PSC患者中发现POT1基因突变,是其他NSCLC亚型的6.7倍。约83%的POT1突变发生在具有DNA结合活性的OB1/OB2结构域中。POT1的OB1/OB2结构域功能障碍可能导致ATR异常激活,提示ATR激酶抑制剂如AZD6738153或VX-970具有治疗活性。
肺原发涎腺型肿瘤
对MEC的研究揭示了MAML2重排诱导的NOTCH和EGFR信号通路,并通过靶向这两条通路增强了抗MEC活性。遗憾的是,肺MEC中MAML2重排的机制尚不清楚。
约一半的肺ACC携带t(6;9) (q22-23;p23-24)染色体易位伴MYB-NFIB(核因子IB)基因融合,该基因编码一种难以靶向的转录调节因子。有趣的是,在ACC中,MYB-NFIB融合是由AKT依赖性IGF1R信号传导,并且在体外数据表明,药物抑制IGF1R可降低细胞增殖。在包含7例肺ACC的队列中,3例有PI3K通路的基因变异。因此,抑制IGF/PI3K/AKT信号通路可能是肺ACC的治疗机会。
靶向肿瘤细胞
嵌合抗原受体(CAR)-T细胞(CAR-T)疗法是一种嵌合抗原受体T细胞新型肿瘤免疫治疗方法。实体瘤的CAR-T疗法正在蓬勃发展,如靶向肺癌的EGFR、ERBB2、c-MET、PD-L1和B7H3。
在罕见肺癌中,上述LASC和PSC中EGFR突变相对常见。EGFR CAR-T细胞治疗已在晚期复发/难治性NSCLC的Ⅰ期临床试验中被证实具有抑制肿瘤生长的作用,达到部分缓解(2/11)和疾病稳定(5/11)。另一项Ⅰ期研究显示,中位PFS为7.13个月,中位OS为15.63个月。遗憾的是,上述研究并未纳入罕见肺癌。目前,一项早期Ⅰ期临床试验旨在评估EGFR/B7H3 CAR-T细胞治疗对肺癌的疗效(NCT05341492)。此外,42.9%的LASC、17.0%-40.9%的PSC和15.6%的LCC存在MET突变或扩增导致的c-MET过表达。临床前研究表明,c-MET CAR-T细胞治疗在体内外均能杀伤NSCLC细胞。LCC、LASC、肺淋巴上皮癌(pLEC)和PSC中PD-L1高表达可能提示PD-L1-CAR-T细胞治疗有效。最近的一项研究表明,PD-L1-CAR-T细胞治疗对PD-L1高表达的异种移植NSCLC肿瘤具有稳健的疗效,而且放疗可提高对PD-L1低表达的NSCLC患者的疗效。
临床前研究模型
临床前研究模型,包括细胞系、患者来源的类器官(PDO)和小鼠模型,将有助于发现肿瘤发生机制和药物靶点。细胞系显示出高成功率、高重复性和低成本,而这些同质癌细胞无法形成与患者来源肿瘤相似的肿瘤微环境。与细胞系相比,PDO可能是一个理想的体外模型,因为其在很大程度上保留了组织学和遗传学特征,并且比病人来源的异种移植(PDX)需要更少的时间来建立。小鼠模型主要包括基因工程小鼠模型(GEMM)和PDX。GEMM主要优势在于携带核心通路的基因变异,从而部分再现临床表型。相比之下,据报道PDX可以更好地保留原始肿瘤的异质性,而GEMM和PDX的应用都受到长潜伏期和不完全外显的限制。迄今,罕见肺癌的临床前模型取得了进展。
肺腺鳞癌
LASC的形态学异质性使其成为研究NSCLC转分化和克隆演变的理想模型。有几种LASC细胞系可用(表S1)。此外,鉴于LASC中STK11/LKB1的突变率(22%)高于ADC (15%), Zhang等人通过KRAS激活伴LKB1缺失建立了LASC小鼠模型。多项研究证实了KRAS/LKB1突变促进LASC的致瘤能力。最近的一项LASC全外显子组测序研究也表明,SOX2扩增和STK11/LKB1缺失可能促进了从LUAD到LUSC的腺鳞转分化(AST)。然而,目前还没有药物在KRAS/LKB1突变交换小鼠中进行试验。此外,LASC的一些PDXs是可用的,但尚未用于测试治疗反应(表4)。
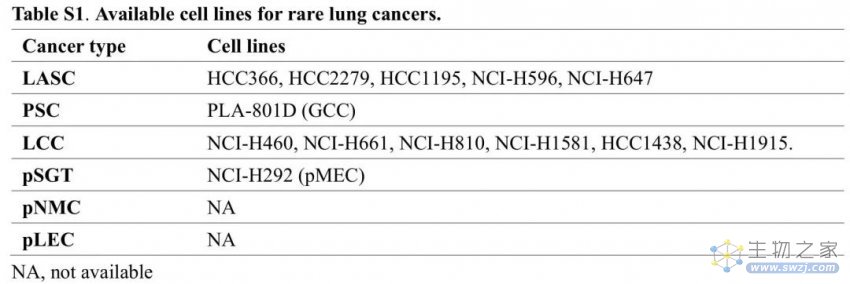
表S1 罕见肺癌的可用细胞系
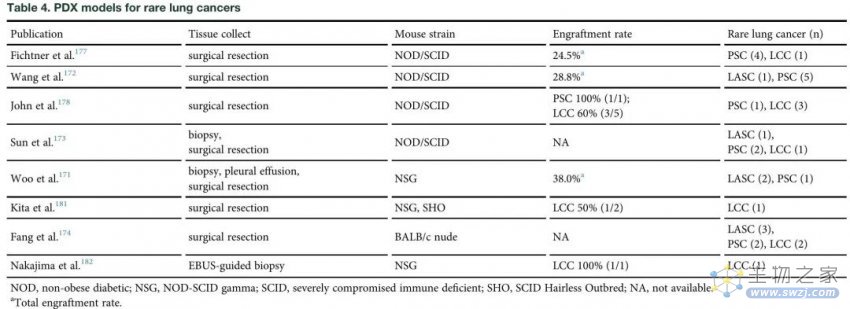
表4 用于罕见肺癌的PDX模型
肺肉瘤样癌
目前已建立的PSC细胞系较少(表S1)。此外,Lázaro等人通过PTEN和TP53共缺失建立了第一个PSC小鼠模型,尽管潜伏期长且不完全外显。PSC模型与LUAD具有基因相似性,EMT标志基因特异性富集。此外,已经确定了PSC的几个PDOs和PDXs(表4),而迄今为止很少进行药物敏感性试验。
大细胞癌
有多种细胞系可用于LCC的研究(表S1)。通过研究LCC的侵袭机制,Gabasa等人发现了一种基于LCC细胞系与肿瘤相关成纤维细胞共培养的体外模型,该模型可用于测试潜在的治疗方法。此外,一些研究报道了LCC的PDXs(表4),但由于LCC定义的变化,每项研究的准确病理类型仍不确定。
挑战与前景
几十年来,针对罕见肺癌的靶向治疗在很大程度上依赖于对常见亚型的研究。幸运的是,在先进基因测序技术的帮助下,靶向治疗得到了越来越多的探索,并且在罕见肺癌患者中显示出了有前景的疗效(图2),并且基于其他研究数据的全面突变谱已可视化,有助于探索新的治疗机会(图3),并提供了详细信息。更重要的是,解决什么问题和如何实现治疗目标是讨论的关键。具体而言,每一种罕见肺癌在未来的靶向治疗发展中都有不同的方向,但值得注意的是,其共同的特点,即罕见性,提出了共同的问题和解决方案。
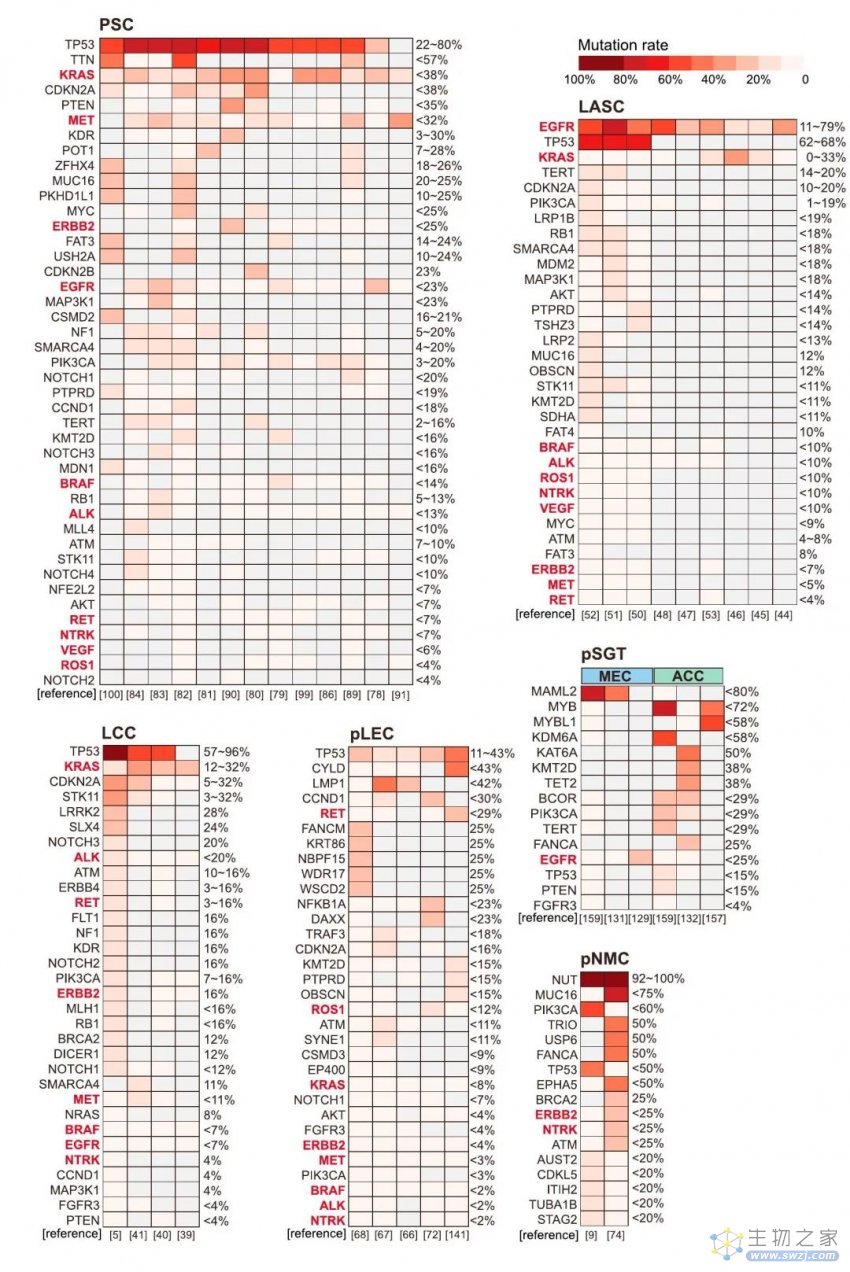

图3 罕见肺癌突变率报告摘要
每种罕见肺癌的前景
·大细胞癌
LCC中很少检测到可靶向突变,KRAS抑制剂和免疫治疗的价值有待进一步验证。LCC通常被认为是没有明确免疫组织化学特征的肺癌亚型,而一些研究揭示了LCC和LUAD之间相似的突变模式。因此,对LCC进行全面的分子分型,有望对其进一步的分类和更精准的个体化治疗。
·肺腺鳞癌
建议对EGFR基因突变进行常规检测,EGFR-TKIs的疗效值得进一步证实,尤其在东亚地区。抑制PD-1/PD-L1通路在PD-L1高表达的LASC患者中显示出治疗潜力,有望在更大规模的研究中得到验证。此外,开发靶向MET过表达的CAR-T疗法可能值得探索。
·肺淋巴上皮癌
基于pLEC和NPC之间的基因相似性,针对EBNA1和PD-L1的靶向治疗在pLEC患者中具有重要价值,需要进一步研究。研究NF-κB信号通路在pLEC中的作用,特别是利用TRAF3缺失来增强ICI的疗效意义深远。
·肺睾丸核蛋白中线癌
由于pNMC不太可能从传统的肺癌靶向治疗中获益,因此迫切需要开发针对BRD3/4-NUT基因融合的药物来改善pNMC的预后。
·肺肉瘤样癌
EGFR-TKIs的疗效已在几项回顾性研究中得到证实,但仍需要在更大的队列中进行前瞻性研究证据,尤其是在中国患者中。PSC患者可靶向MET突变,但不可避免地会出现对MET抑制剂耐药。为了克服耐药性,联合靶向药物或开发双特异性抗体(如EGFR/c-Met双抗药物Amivantamab[埃万妥单抗]),值得进一步探索。研发针对MET过表达的CAR-T疗法可能适用于不适合目前抗MET小分子药物治疗的患者。此外,ICI和抗血管生成治疗的协同作用应得到充分利用。POT1突变在PSC肿瘤发生中的作用有待于进一步明确。
·肺原发涎腺型肿瘤
肺SGT缺乏肺癌的经典驱动突变,并且很少对当前的肺癌靶向治疗有反应。SGT的机制发现,以及相应的靶向治疗,需要在肺部SGT患者中进一步研究验证。
罕见肺癌的常见问题和解决方案
不同罕见肺癌的共同问题包括:(1)缺乏对致瘤机制的全面分析,进一步误导临床实践;(2)机制研究和靶向药物筛选的临床前模型不完善;(3)不确凿的临床证据,如回顾性研究、病例报告和根据监测、流行病学和最终结果(SEER)登记的分析;(4)缺乏可用于基础研究和临床实践的样本和数据集。相应地,应在以下几个方面作出更多努力。
揭示致癌机制
整合基因组学、转录组学、表观基因组学、蛋白质组学和代谢组学等多维信息,揭示相互作用网络。NGS已广泛用于罕见肺癌的研究,而单细胞测序可以作为补充工具,在单细胞分辨率下实现ITH和免疫微环境的无偏倚分析。迄今为止,单细胞RNA测序已经在一些罕见的肺癌中进行,如PSC和肺LEC。利用对罕见肺癌的单细胞分析可以提供新的分子见解。此外,蛋白质作为病理过程的实际执行者和基因型与表型之间的桥梁,凸显了蛋白质组学的作用。以质谱为核心的传统蛋白质组学在不久的将来将向深入单细胞和单分子测序方向发展,以补充单细胞基因组学和转录组学随着越来越多的分子调控网络被发现,基于不同临床前模型的研究对于验证癌基因以及阐明基因型和表型之间的关系是不可或缺的。
开发临床前模型
在罕见肺癌细胞系中进行高通量CRISPR筛选将有助于药物靶点的识别和耐药机制的阐明。例如,p53蛋白逐渐摒弃了“不可成药”的想法,许多小分子药物正在研究中。在超过一半的LASC、PSC、LCC和肺NMC患者中观察到TP53改变,因此使其成为罕见肺癌的一个有吸引力的靶点。PDO是目前评价药物反应的最优体外模型。采用更高效的前沿技术,如利用微孔阵列芯片构建肺癌类器官,可能会缓解临床样本稀缺的问题。利用体内模型(如GEMM和PDX)对体外模型筛选的药物进行测试,在罕见肺癌中更具成本效益。PDO和PDX的生成主要依赖于临床组织样本,因此,迫切需要建立罕见肺癌的生物样本库。
创新临床研究
首先,需要更多罕见亚型的病例被纳入肺癌的临床试验,并给出每个亚型的详细结果。其次,传统临床试验可以通过其他策略改进,如多中心招募、析因设计和适应性设计(如优化纳入人数较少、改变结局指标的贝叶斯分析方法)。在此基础上,对癌症生物学的更深入了解可能会拓宽纳入标准并促进新的临床试验设计,例如篮子试验和伞式试验。一个典型的例子是NCI-MATCH试验,这是迄今为止最大的篮子试验,其允许患者基于基因变异接受治疗,无论癌症类型如何。第三,如果前瞻性试验仍然受到患者稀缺的阻碍,那么应将真实世界数据视为有价值的资源,作为预设的外部对照。电子病历的改进有望使大规模多中心观察性研究得以开展。
加强资源整合分析
首先,优化临床注册,提供罕见肺癌的病理、治疗和标本等数据,有助于建立临床前模型和进行多组学分析等前沿研究。值得注意的是,收集初次诊断、复发和转移的样本可能对分析罕见肺癌的进化图谱有很大帮助。其次,应该建立基础和临床资源共享的平台,为更好的临床决策提供有价值的信息,协助多中心合作以便招募患者参加临床试验。
综上所述,针对罕见肺癌的靶向治疗取得了进展,但仍有很大的改进空间。目前发展罕见肺癌靶向治疗的总体原则可以用“求同存异”来描述,即在注意到当前靶向治疗的疗效的同时,也要关注罕见肺癌是否存在不同于常见亚型的基因变异或致癌特征,以达到更加个体化的治疗。值得注意的是,基因变异与组织学特征之间的明确相关性仍需进一步研究,如基因组景观的比较研究或机制验证。未来可能根据分子特征重新定义罕见肺癌或建立更全面的以治疗为导向的诊断体系,从而实现个体化的精准治疗。
参考文献:Wang C, Yuan X, Xue J. Targeted therapy for rare lung cancers: Status, challenges, and prospects. Mol Ther. 2023 May 13:S1525-0016(23)00263-0. doi: 10.1016/j.ymthe.2023.05.007. Epub ahead of print. PMID: 37179456.