CIRISPR-Cas是细菌和古菌的免疫防御系统。2012年6月28日,Jennifer Doudna、Emmanuelle Charpentier 等人在 Science 期刊发表论文,揭示了CRISPR-Cas9的详细作用机制,并指出了其作为基因组编辑工具的潜力。
此后,在张锋、George Church、亓磊、刘如谦等人的推动下,CRISPR基因编辑技术快速发展,成为最简单高效的基因编辑工具,在基因功能研究、药物靶点筛选、遗传疾病治疗、癌症研究、作物育种等领域取得了突破性成就。但我们对于天然CRISPR系统的一些生物学过程的认知仍十分有限。
2023年6月14日,CRISPR基因编辑先驱、诺奖得主、加州大学伯克利分校的 Jennifer Doudna 教授团队在 Nature 期刊发表了题为:Genome expansion by a CRISPR trimmer-integrase 的研究论文。
该研究展示了I-E型CRISPR系统如何使用一个宿主内天然存在的DnaQ样外切酶(DEDDh)和Cas1-Cas2的复合物(修剪-整合酶),来选择和加工原间隔邻近基序(PAM),从而实现CRISPR RNA的捕获、修剪和整合。
该研究揭示了一种外切酶辅助PAM序列加工的新机制,证明了CRISPR系统进化出多种机制,以确保入侵遗传原件(例如噬菌体)的强大适应性免疫,并同时避免自身免疫。

归根结底,CRISPR基因编辑技术源自原核生物的CRISPR-Cas适应性免疫系统,主要由Cas效应蛋白和CRISPR阵列组成。CRISPR序列阵列由短重复序列和大约30 bp的外源DNA衍生间隔序列(spacer)组成,该序列转录和加工产生成熟的CRISPR RNA(又称gRNA,向导RNA),引导Cas蛋白识别外源DNA(例如噬菌体的DNA),从而保护宿主细胞免受侵袭。
在DNA靶向的CRISPR系统中,例如Cas9和Cas12,还需要识别一段2-5bp的PAM基序,这是区分自我和非自我并避免自身免疫的关键组分。协同选择和去除PAM确保Cas效应蛋白只针对真正的入侵DNA,而不是宿主CRISPR阵列。
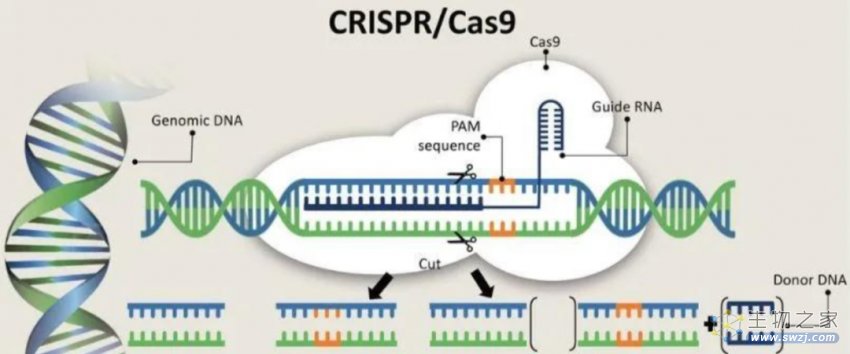
PAM序列对于CRISPR系统识别靶标DNA是必须的
由此可见,PAM的选择和去除在维持原核生物的适应性免疫和基因组完整性方面起着十分关键的作用。值得注意的是,在包括II-B型、部分V型和I-A、I-B、I-C、I-D和I-G型在内的CRISPR系统中,由Cas4内切酶进行PAM序列的选择和加工。
然而,大约40%的CRISPR亚型缺乏Cas4。在缺乏Cas4的系统中,例如普通实验室大肠杆菌K12菌株的I-E型系统,Cas1包含一个PAM结合袋,被认为参与了原间隔序列前体(prespacer)的选择。遗憾的是,目前对于Cas1是否以与Cas4相似的方式切割PAM,还是依赖宿主核酸酶来完成这一功能尚不清楚。
最近的体外研究发现宿主外切酶在原间隔序列前体修剪中有能力帮助Cas1-Cas2。独立的外切酶,例如DnaQ样外切酶DEDDh,是广泛存在于每种CRISPR-Cas类型中的辅助成分。此外,I-E型系统含有天然的Cas2/DEDDh外切酶融合,进一步表明外切酶与CRISPR整合酶之间存在功能联系。这些系统为研究宿主外切酶和CRISPR整合酶之间的协调提供了一个模型。
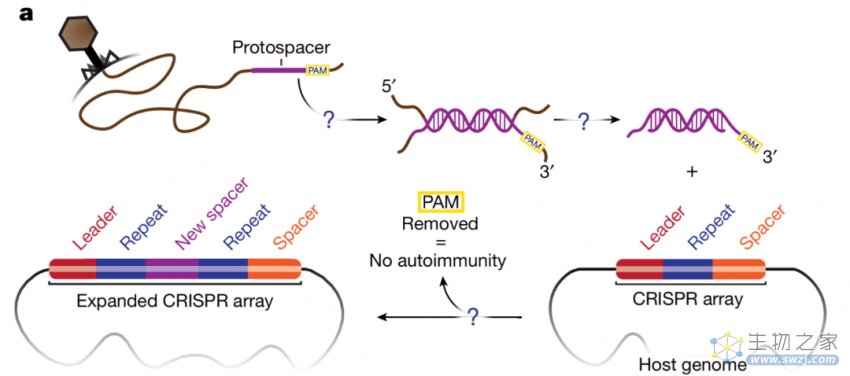
CRISPR系统中原间隔序列前体(prespacer)的选择和整合
在这项最新研究中,研究团队通过天然存在的Megasphaera NM10(巨形球菌NM10)相关的Cas2和DEDDh融合蛋白(Cas2/DEDDh)与Cas1复合物(Cas1-Cas2/DEDDh)重建CRISPR序列的捕获、加工和整合。
研究团队发现,Cas1-Cas2/DEDDh在原间隔序列前体处理和整合的第一步中保留了PAM,但在完成整合之前会将PAM序列删除。有意思的,是DEDDh的活性位点,而不是Cas1,负责最初的CRISPR RNA 3' overhang修剪和PAM去除。
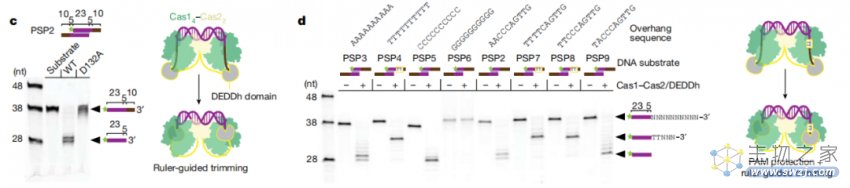
Cas1-Cas2/DEDDh将原间隔序列前体(prespacer)处理到正确的大小进行整合,并保护TT PAM
这一机制不同于Cas4的内切机制,表明宿主外切酶在PAM加工中发挥不同的作用。整合酶通过一种规则引导的、门控机制来调节DEDDh外切酶的活性,该机制协调处理并定义整合DNA的长度。
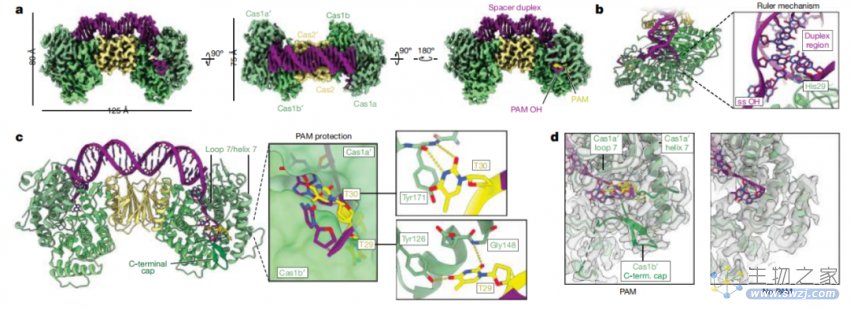
Cas1-Cas2/DEDDh在原间隔序列前体(prespacer)加工过程中的分子细节
研究团队还通过冷冻电镜技术重建了Cas1-Cas2 /DEDDh与原间隔序列结合的结构,显示了Cas1-Cas2如何识别该序列并保护其免受DEDDh介导的修剪。半整合结构的构象分析表明,一旦锚定到CRISPR阵列中,DNA弯曲会进入Cas1的C端区域,这反过来暴露了PAM并将其去除,从而实现完全整合。
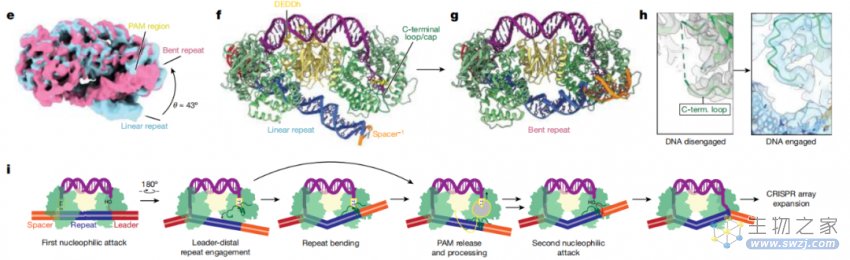
Cas1-Cas2/DEDDh PAM加工的生化和结构分析
总而言之,这项研究结果阐明了一种宿主外切酶辅助PAM加工的机制,并证明CRISPR系统进化出多种机制,以确保对入侵遗传原件(例如噬菌体DNA)的强大适应性免疫并同时避免自身免疫。
论文链接:https://www.nature.com/articles/s41586-023-06178-2