美国食品药品监督管理局官宣批准两款治疗镰状细胞病(SCD)基因编辑疗法,其中也包括首款应用“基因剪刀”——CRISPR/Cas9技术的疗法Casgevy。

(来源:FDA)
Casgevy由美股上市公司福泰制药与CRISPR医药共同研发。值得一提的是,凭借发现CRISPR技术共同分享2020年诺贝尔化学奖的法国科学家埃玛纽埃勒·沙尔庞捷,正是CRISPR医药的创始人之一。

(2020年诺贝尔化学奖由沙尔庞捷与美国科学家道德纳共享,来源:诺贝尔奖官网)
由于这类疗法的广阔前景和诺奖背景,Casgevy在审批阶段一直受到医药圈和资本市场的强烈关注,财联社此前也多次报道过相关进程。
由于此前已经报道过多次,所以这里就用最简单的方式来概述Casgevy的相关信息:
治什么病:镰状细胞病是血红蛋白(红细胞中的携氧蛋白)的一种遗传性基因异常。异常红细胞会堵住毛细血管,引发终生持续疼痛、器官损害等后果,需要持续输血维持生命
怎么治:提取患者自己的造血干细胞进行编辑,同时患者进行化疗清除骨髓中的问题细胞,最后回输编辑好的造血干细胞
优点:无需进行配型、试验阶段绝大多数接受治疗的患者在后续一年内未出现出现复发性血管闭塞危象,输血需求大大减少
缺点:贵、尚不清楚基因编辑是否会引发长期不良后果
今天一同过审的还有蓝鸟生物的Lyfgenia,适应症、适用范围与Casgevy一样。治疗的过程也差不多,都是提取患者自己的细胞进行编辑。两者之间的区别是,Lyfgenia使用逆转录病毒载体进行基因修改,使得患者红细胞中产生一种衍生血红蛋白,功能与正常成人血红蛋白A类似。
可能因为这一进展早已被市场广泛预期,所以这一结果引发了两家创新药企的明显下跌。截至发稿,市值接近900亿美元的福泰制药小幅下跌近1%、CRISPR医药跌超7%、蓝鸟生物跌近38%。
基础科学突破“闪电落地”
沙尔庞捷与道德纳是在2012年的一篇论文中,阐述了CRISPR的基因编辑能力。只用了十年,这项前沿技术突破就成功转化为商业产品,速度可以说是“异常快”。
早在这篇论文发表前,美国波士顿儿童医院的研究人员已经找到了抑制子宫中的胎儿产生特定血红蛋白的“问题基因”。
随着新工具问世,研究人员成功使用CRISPR“关闭”问题基因,恢复血红蛋白生成,并将这项技术应用在成人SCD的治疗中。后续,波士顿儿童医院也将这项技术专利授权给了CRISPR医药。
参与这项研究的Daniel Bauer博士感叹称,这项技术能够以这么快的速度,从实验室里的基础科学转变为有望帮助很多人的疗法,真是令人感到惊奇。
仍有长期问题需要解答
虽然基因编辑疗法是潜在“一劳永逸”的最先进治疗手段,但它们也有普遍的问题——贵。
作为参考,虽然我们现在还没看到Casgevy的售价,但蓝鸟生物已经在第一时间宣布Lyfgenia的批发收购价格为310万美元。专门评估合理药价的NGO临床和经济审查研究所此前曾估计,Casgevy的价格可能要接近200万美元。
除了药物可及性外,基因编辑中的“脱靶”——基因编辑工具除了预期靶标之外还切割了其他DNA片段的情况,也是可以预见但尚无确切案例的风险点。
对于种种长期风险,2020年参与Casgevy临床试验的Christopher Vega接受媒体采访时表示,他对此并不担心,很高兴能够拥有摆脱慢性疼痛问题的人生。
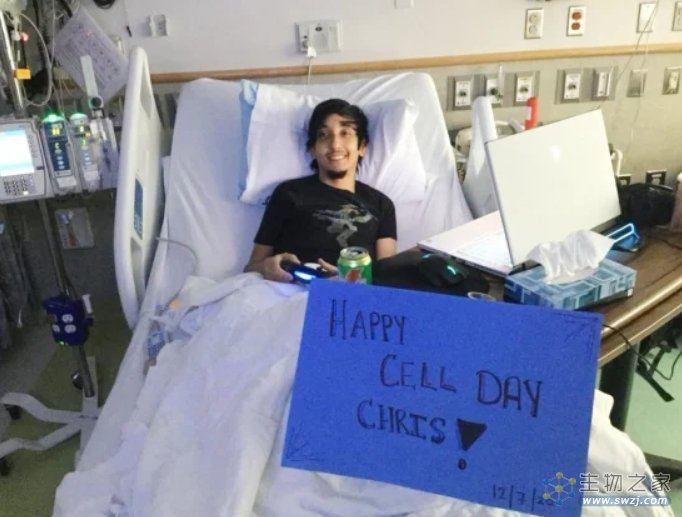
(Vega在2020年接受造血干细胞回输的当天,来源:Christopher Vega)
今年31岁的Vega从儿童时期开始,就因为SCD引发的疼痛危机需要每年住院治疗。
虽然接受Casgevy治疗的过程并不轻松——Vega暂时失去了头发,出现虚弱、恶心、皮疹等症状,但他说这一切都是值得的。
Vega表示,他现在已经是一个“完全不同的人”了,正在念洛杉矶电影学院视觉效果专业的网课,同时照顾5岁的女儿。他说:“有时我会有一些焦虑的瞬间,担心可能会再度出现疼痛危机,但经过了这么多年,我慢慢接受了这个现实,我知道我现在的状态很好。”































