痛苦是人生永恒的议题,也催生了无数直击人心的文学创作,但它真的是必要存在的吗?一直以来,这样一种说法广为流传:苦难是人生的财富,因为宝剑锋从磨砺出,梅花香自苦寒来。不过,前段时间“钢腿女孩”牛珏在纪念汶川地震15周年的微博中提到的一段话,同样让许多网友触动。她的父亲,在听到记者对她说“你应该感谢你受过的苦难”后,反驳道:“苦难有什么好感谢的,她应该感谢她自己,感谢每一个帮助过她的人。”
同样是前段时间,剖腹产的话题登上热搜,也使得许多人了解到了无痛分娩这样一个概念,同时也暴露出了实际中多以让产妇忍耐为办法的现状。原因有很多,包括客观的麻醉科医生的短缺问题,以及主观上的认为疼痛是生产过程中不可或缺的一段体验,或者是认为无痛会对胎儿产生负面影响等。
不过,不论是心灵上还是生理上的痛苦,都有其生存和进化上的意义。比如当面对野外凶猛的捕食者时,紧张和恐惧使人类知道躲避,提高生存的机会。疼痛某种意义上也是一种讯号,提醒你在触碰到高温或者尖锐的东西及时抽手,或者尽快处理创伤。其重要性尤其体现在那些患有先天性无痛症(Congenital Insensitivity to Pain,CIP)的人的身上,他们会咀嚼自己的嘴唇、舌头、手指,并且经常发生烫伤、割伤、撞伤而不自知,如果未能及早发现并施以特别的呵护,先天性无痛症患者很难活到成年。可是,随着时间来到现代社会,紧张、焦虑等情绪,以及持续超过数月的慢性疼痛,通常不再带来生存上的收益,而仅仅只是一种折磨。
Jo Cameron:我知道“痛苦”这个词,我也看到了疼痛,但我指的是抽象的概念
同样像其他CIP患者一样感觉不到疼痛,苏格兰女性Jo Cameron却是特殊的,在她的一生中,从未真正体验过任何的痛苦,但依然顺遂地跨入了古稀之年。

图1 Jo Cameron的自拍(图源:伦敦大学学院)
她也经常受伤,比如在烤炉上烫伤自己的胳膊,然后闻到了烧焦的肉味,才开始意识到自己的皮肤被灼伤了。小时候她在滑旱冰时摔伤了手臂,但直到母亲注意到她手臂的角度很奇怪,她才知道自己手臂断了。但幸运的是,Cameron的伤口总是很快愈合。
Cameron对疼痛的无感使她轻松度过了分娩,在吃辣这件事上,也只是体会到口腔里有一种“令人愉悦的闪光”。

图2 Cameron与丈夫、麻醉医生一起挑战辣椒(图源:bbc)
在Cameron的回忆中,她也未曾经历过极端的愤怒、恐惧、悲伤、焦虑或恐惧。当儿子挨打变得鼻青脸肿时,她虽然知道儿子需要她,却并不担心;当她被学生吐口水或盗窃时(Cameron曾是一名特殊教育教师),也并不生气;甚至面对母亲的过世,她也没有悲伤。
但直到65岁,她才在医生的提醒下,注意到自己的与众不同。由于关节炎,她的手已经变形到无法正确握笔,医生打算为她切除拇指根部的一块骨头,然而面对医生口中这种“难以忍受”的手术,她并未表现出痛感。医生注意到了这种异常,随后发现在她的病历上,之前的髋关节手术也没有为疼痛采取任何措施,医生将她介绍给了伦敦大学学院的疼痛专家。
科学家们对她的心理状态也充满兴趣。在随后的焦虑和抑郁测试中,Cameron都得到了最低的零分。耶鲁大学心理学教授、《反对同理心》一书的作者Paul Bloom也从Cameron身上看到了他一直以来坚持的理论:不需要同理心(empathy),即不需要对别人的痛苦感同身受,仍然可以快乐而充满同情心(compassion)地帮助别人。
让痛觉消失的基因不止一种
科学家们对CIP患者的关注由来已久。2006年,剑桥遗传学家Geoff Woods在Nature上发表论文,记录了来自巴勒斯坦北部三个家族的六名CIP患儿。六名患儿都是近亲结婚的产物,因而更容易绘制出他们的基因图谱。作者发现,这六名儿童的编码钠离子通道亚型1.7蛋白(Nav1.7)的SCN9A基因都存在突变,Nav1.7功能的丧失,使得他们失去了痛觉和嗅觉。
2013年,德国吕贝克大学神经学教授Enrico Leipold又报道了另一种罕见的SCN11A突变,可致使Nav1.9通道在静息电位下表现出过度活动,损害伤害感受器的动作电位的生产和突触传递。
2018年,Woods的前研究员、现伦敦大学学院遗传学家James Cox在意大利的Marsili家族的6名成员身上发现了ZFHX2基因的一个突变。这些人很少出汗,只会短暂地感到疼痛,并且对热不敏感。ZFHX2基因编码一个在小直径感觉神经元中表达的推定的转录因子。
而Cameron的与众不同,首先表现在内源性大麻素的代谢上——内源性大麻素可减轻人的压力反应,通常被一种名为脂肪酸酰胺水解酶(fatty acid amide hydrolase,FAAH)的酶分解。而Cameron的FAAH基因发生了突变,降低了该酶的效率,这使得她体内的内源性大麻素水平升高,并表现出低水平的焦虑、健康和无忧无虑的举止。
但不同于其他FAAH基因突变的人,Cameron的疼痛阈值高得惊人,这说明她身上还有其它因素在起作用。经过六年的寻找,Cox团队发现Cameron身上的FAAH基因下游的“假基因”存在着一个~8 kb的杂合微缺失,研究人员将之命名为“FAAH-OUT”。相比之下,Cameron的女儿和母亲就没有携带该微缺失,也未表现出对疼痛的不敏感性,而她的儿子是微缺失的杂合子,但没有导致FAAH功能受损的其他突变,因此对疼痛表现出了部分的不敏感。在Cameron的回忆里,她已过世的父亲生前从未使用过任何止痛药,Cameron怀疑,FAAH-OUT突变遗传自她的父亲。
但Cox并不喜欢“假基因”这个称呼。他强调:“假基因被认为是进化过程中形成的无功能残留物。但FAAH-OUT是表达的,就像我曾经采访过的一位生物化学家所比喻的那样,假基因就像森林里偶然发现的生锈汽车,在Cameron的例子里,钥匙启动点火开关,汽车启动了。”

图3 James Cox(图源:伦敦大学学院)
历时四年,分子机制终破解
Cameron的出现让科学家们感到痴迷,并希望从中学习到得以缓解疼痛、对抗焦虑的新方法。据统计,慢性疼痛影响着全球30%的人口,对个人生活质量、心理健康和社会功能都造成巨大影响。此外,阿片类药物的过度使用更导致了成瘾和死亡等风险,过去二十年中开发的FAAH抑制药物也均未成功进入临床。
2023年5月24日,Cox团队在Brain上发表题为“Molecular basis of FAAH-OUT-associated human pain insensitivity”的论文,在分子水平回答了使得Cameron无痛觉、低焦虑、伤口愈合快速的原因,为未来开发靶向FAAH的疼痛、焦虑、抑郁和其他神经系统疾病的治疗方法奠定了基础。

图4 研究成果(图源:[5])
研究人员使用CRISPR/Cas9技术编辑人胚肾细胞系来模拟Cameron的FAAH-OUT微缺失,结果引起了FAAH-OUT和FAAH mRNA的显著减少。FAAH-OUT的表观遗传沉默也导致FAAH-OUT和FAAH表达水平降低,说明,FAAH-OUT转录有助于FAAH以正常水平表达,FAAH-OUT的产物可能类似于增强子lncRNA,可调控上游基因的表达。
研究人员通过检索UCSC Genome Browser在FAAH-OUT的第一个内含子中识别出一个高度保守的元件FAAH-AMP,通过进一步的研究证实,该元件在组蛋白标记上和实际功能上都与一个增强子元件相当。
考虑到某些IncRNA可以调节目标启动子/增强子区域的状态,而FAAH启动子具有强烈且保守的CpG岛,因此FAAH-OUT IncRNA极可能通过调节DNA甲基化状态来调控FAAH表达。事实上,研究人员发现,在在FAAH-OUT表达降低的杂合子细胞中,甲基化水平从原来的40%上升到60%,且增加了DNA-甲基转移酶1在FAAH启动子处的富集。
对Cameron及对照组的衍生成纤维细胞进行转录组学分析发现,Cameron表现出797个基因上调,348个基因下调,其中某些基因产物组参与了WNT诱导的信号传导、伤口愈合、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)信号传导和 G 蛋白信号传导。
特别值得注意的是,BDNF显著上调。在野生型小鼠身上注射FAAH抑制剂可使海马BDNF水平增加约25%,而过去的研究表明BDNF与TRKB(一种BDNF受体)结合具有抗抑郁作用。另一个值得注意的是ACKR3的显著下调。ACKR3是一种广谱的阿片类清道夫受体,可以结合和内化多种类型的阿片类药物,ACKR3的下调可使得阿片类药物的清除减少,在体内效应增强。令人兴奋的是,通过遗传手段或药理学手段在小鼠身上抑制FAAH活性,都可以观察到皮肤伤口加速愈合,这表明FAAH也可以作为伤口愈合的潜在治疗靶点。
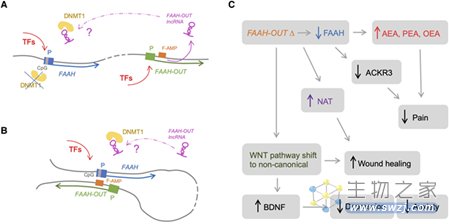
图5 FAAH-OUT调节FAAH及其他基因表达(图源:[5])
Cox表示:“Jo Cameron 的表型如此独特,能够准确地在分子水平上了解发生的一切令人非常兴奋。从现在开始,我们有了开发药物的可能性,并有望给出慢性疼痛、抑郁、焦虑、伤口愈合的全新治疗方案。”
参考资料:
[1]https://www.newyorker.com/magazine/2020/01/13/a-world-without-pain
[2]https://www.theguardian.com/science/2019/mar/28/scientists-find-genetic-mutation-that-makes-woman-feel-no-pain
[3]Cox JJ, Reimann F, Nicholas AK, et al. An SCN9A channelopathy causes congenital inability to experience pain. Nature. 2006 Dec 14;444(7121):894-8. doi: 10.1038/nature05413.
[4]Habib AM, Matsuyama A, Okorokov AL, et al. A novel human pain insensitivity disorder caused by a point mutation in ZFHX2. Brain. 2018 Feb 1;141(2):365-376. doi: 10.1093/brain/awx326.
[5]Mikaeili H, Habib AM, Yeung CW, et al. Molecular basis of FAAH-OUT-associated human pain insensitivity. Brain. 2023 May 24:awad098. doi: 10.1093/brain/awad098. [6]https://www.ucl.ac.uk/news/2023/may/study-reveals-unique-molecular-machinery-woman-who-cant-feel-pain































