今日,在美国FDA召开的咨询会议中,与会专家以8:6非常微弱的优势,投票支持Sarepta Therapeutics和罗氏(Roche)联合开发的基因疗法SRP-9001通过加速批准通道上市,治疗杜氏肌营养不良(DMD)患者。此前,美国FDA生物制品评价和研究中心主任Peter Marks博士多次表示,利用加速批准通道是加快基因疗法上市速度的重要举措之一,尤其针对难于通过传统临床试验评估疗法的罕见疾病。考虑到这是在研的基因疗法首次试图通过加速批准通道上市,这一会议也得到业界的广泛关注。产业媒体指出,这一投票结果非常接近。虽然从结果看支持SRP-9001的加速批准,但我们也需要注意,FDA并不是必须听从委员会的建议。这款药物最终获批与否,将在本月最终揭晓答案。

DMD和SRP-9001简介
DMD是一种罕见的X-染色体连锁遗传疾病,是由于在X染色体上编码抗肌萎缩蛋白(dystrophin)的基因出现突变而导致。患者在出生后不久就会出现炎症反应,导致肌肉纤维化以及肌肉的萎缩与退化。由于呼吸与/或心脏衰竭之故,DMD患者的预期寿命通常不超过40岁。
SRP-9001(delandistrogene moxeparvovec)是一种在研基因疗法,通过将编码微抗肌萎缩蛋白的转基因递送到肌肉组织,弥补抗肌萎缩蛋白缺失。它的优势在于不论DMD患者携带编码抗肌萎缩蛋白的基因携带哪种类型的突变,都可能从这种疗法中获益。在临床试验中,SRP-9001显著提高患者肌肉中微抗肌萎缩蛋白的表达水平。基于这一生物标志物的表现,Sarepta公司向美国FDA递交了生物制品许可申请(BLA),寻求加速批准。
FDA对申请数据的评估
加速批准通道允许使用替代终点批准治疗具有未竟需求严重疾病的创新疗法。使用这一批准的关键在于替代终点能够有效地预测患者未来的临床获益。比如在治疗癌症患者中,患者的客观缓解率,无复发生存期等临床终点上的改善通常可以有效预测患者的无进展生存期或总生存期方面的改善。在SRP-9001的咨询委员会会议中,SRP-9001介导的微抗肌萎缩蛋白表达水平能否有效预测患者运动功能方面的改善是专家讨论的焦点之一。
FDA的审评人员表示,微抗肌萎缩蛋白表达水平能否有效预测患者运动功能方面的改善可以基于两个方面来判断,一是科学理论,就是从科学角度上讲,增加微抗肌萎缩蛋白表达水平是否应该导致患者肌肉功能增强。二是现实数据,是否有现实数据是否支持微抗肌萎缩蛋白表达水平的升高与肌肉功能增强具有相关性。
由于SRP-9001使用腺相关病毒(AVV)作为递送载体而AAV载体能够包装的基因大小有限,因此SRP-9001表达的微抗肌萎缩蛋白缺少多个野生型抗肌萎缩蛋白中的蛋白域。FDA审评人员表示,这些蛋白域对抗肌萎缩蛋白的完整功能具有重要作用,因此无法确定“迷你版”的微抗肌萎缩蛋白能够有效弥补完整抗肌萎缩蛋白的功能。
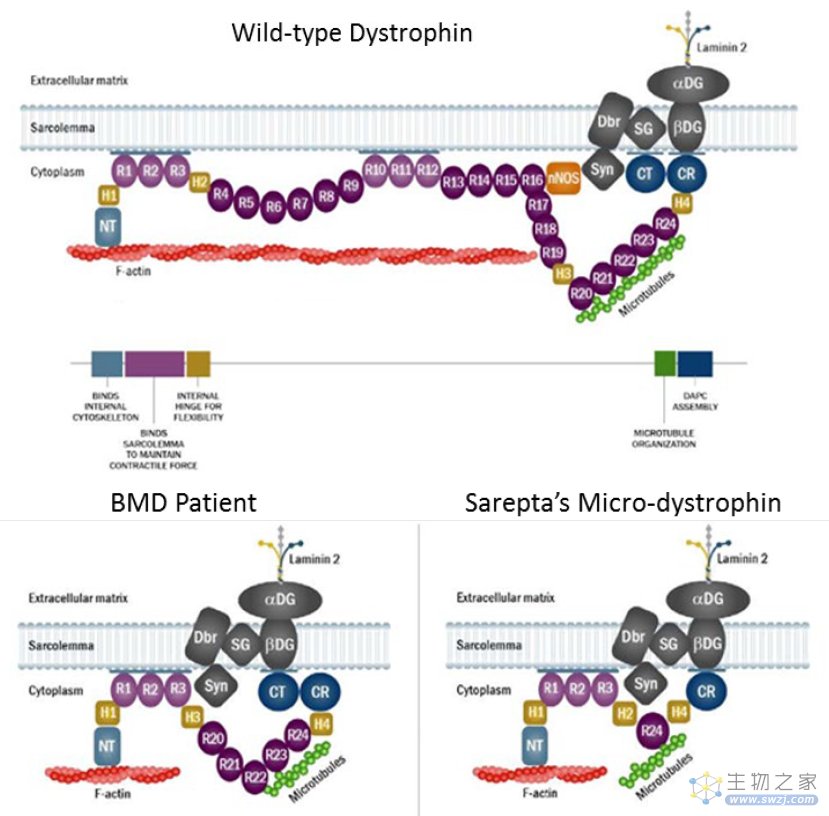
▲SRP-9001表达的微抗肌萎缩蛋白与野生型抗肌萎缩蛋白和贝克型肌营养不良症(BMD)患者携带的突变型抗肌萎缩蛋白(图片来源:FDA官网)
而FDA对SRP-9001临床试验结果的分析显示,在随机双盲的临床试验部分,SRP-9001表达的微抗肌萎缩蛋白水平与评估患者运动能力的NSAA评分的改善之间的关系并不显著。值得一提的是,患者接受治疗时的年龄对相关性有重要影响。在4-5岁患者中,微抗肌萎缩蛋白水平和NSAA评分的相关性较强,而在6-7岁患者中,两者之间没有明确相关性。FDA的审评人员表示,现有数据难于没有疑问地确认SRP-9001的有效性。
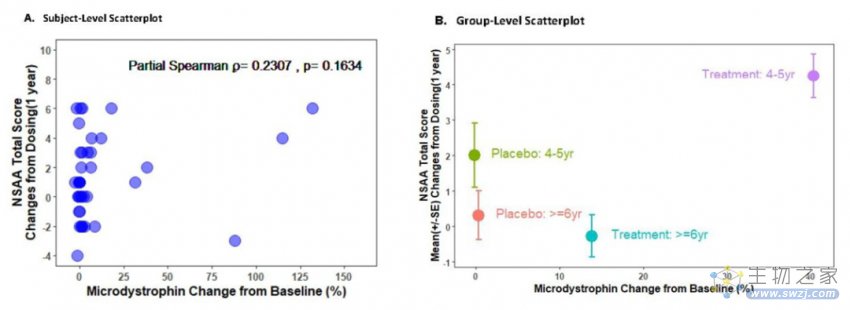
▲微抗肌萎缩蛋白水平与评估患者运动能力的NSAA评分的改善之间的相关关系数据(图片来源:FDA官网)
DMD患者的诉求和医生的反馈
参加咨询委员会的患者代表也分享了他们的体验。参加试验的孩子Connor的母亲Melanie Hennick女士展示了她儿子打橄榄球和冰球的视频。“他能与DMD共存,而不是受其所困!”她说,“这款疗法赋予了他新生。”
相关阅读:3天令一个孩子重获新生,这款基因疗法能如期获批吗?
患者组织Little Hercules Foundation总裁Kelly Maynard女士比较了接受治疗男孩的视频和她自己儿子Jackson的视频。Jackson已经16岁了,从未接受过基因疗法的治疗。
“这位参加试验的患者6岁开始接受治疗,他可以毫无困难地骑自行车。7岁的杰克在做6分钟步行测试时腿已经很无力,他无法自己站起来。”她说,“这位参加试验的11岁患者正在和他的家人一起远足。而8岁半的杰克试图从他的椅子上站起来。令人心碎的是,他做不到。”
“这就是未经治疗的DMD患者的真实状况。”她补充说。她还展示了三个分别在16岁、16岁和10岁去世的男孩图片。
多名治疗DMD的专科医生也在委员会上对SRP-9001的批准表示支持,参加临床试验的医生Aravindhan Veerapandiyan博士描述了自己观察到的显著而且有意义的临床结果。
基因疗法开发的未来
美国FDA已经授予SRP-9001的BLA优先审评资格,预计在今年5月29日之前做出审评决定。尽管今日的投票中,支持其获批的人占到了多数,但专家们的讨论也展示了基因疗法开发仍然面对多种挑战。比如,由于AAV载体的载荷的限制,SRP-9001不得不表达缺乏部分蛋白域的微抗肌萎缩蛋白,这给它能否有效行使正常功能带来了疑问。
此外,全身性注射AAV载体可能引起的免疫反应会让后续使用AAV载体的基因疗法失效,如果SRP-9001效果不明显,患者可能没有机会尝试后续有效的基因疗法。这也是FDA审评人员对支持SRP-9001加速批准表现出疑虑的重要原因之一。

截图来源:FDA官网
可喜的是,业界对这些挑战早有认识并且已经在开发解决这些问题的创新方法。根据药明康德内容团队的统计,在2022年,细胞和基因疗法领域共有95起融资事件,涉及94家新锐公司。从这些新锐公司的技术平台上看,其核心技术均剑指制约领域发展的诸多瓶颈。在所有的公司中,数目最多的当属专注于开发专有载体的新锐,体现基因疗法的递送依然是行业中最为关注的问题。在传统的AAV、腺病毒、慢病毒和脂质纳米颗粒之外,这些新锐有的在开发全新的病毒载体,以求实现精准的组织递送,或是大幅扩大递送的载荷;而有的在打造创新的非病毒载体,使用超声等手段实现基因疗法的特异性递送。
期待这些新技术的进步早日解决基因疗法开发面对的挑战,让更多更好的基因疗法更快地来到患者身边。































