Cap2 是在近 50 年前被发现的,是与 m 一起装饰 mRNA 的五种主要甲基修饰之一。7G, N6,2′-O-二甲基腺苷(m6一个m)、Cap1 和 N6-甲基腺苷(m6尽管转录组中Cap2的患病率很高,但Cap2是最后一个主要的未定位核苷酸修饰。使用CLAM-Cap-seq,研究人员生成了Cap2的转录组范围图谱,该图谱揭示了长寿命mRNA上的强Cap2富集,这是由于转录组中mRNA年龄引导的Cap2沉积而发生的。Cap2的主要功能不是控制mRNA加工事件,如翻译或稳定性,而是进一步抑制内源性RNA激活先天免疫反应的能力。从机制上讲,Cap2中的双重甲基化阻止Cap1与RIG-I结合,从而抑制内源性Cap1 RNA的自身免疫潜力。研究人员还表明,mRNA中Cap2的缓慢,时间依赖性积累代表了一种细胞适应,用于掩盖宿主RNA激活RIG-I。同时,缓慢的Cap2甲基化降低了快速复制的病毒RNA获得Cap2的可能性,从而逃避宿主细胞防御的识别。
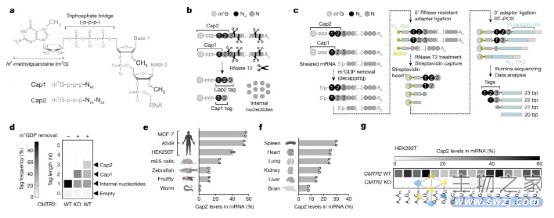
图1:Cap2 是一种在不同序列环境中发现的可变 mRNA 修饰。
细胞需要区分自身和非自身RNA的机制。mRNA帽的甲基化是标记自身mRNA的主要机制之一。缺乏核糖甲基化的Cap0 RNA是RIG-I的高亲和力配体和有效激活剂。因此,少量的Cap0可以激活先天免疫反应。Cap1中单个甲基的存在足以降低RNA激活RIG-I的能力。尽管Cap0与RIG-I的结合亲和力为2 nM,但Cap1仍以425 nM的亲和力结合。研究人员发现,通过消耗CMTR1或病毒感染获得的大量Cap2 RNA可以提供足够水平的Cap1来激活RIG-I。因此,即使Cap1仅微弱地激活RIG-I,细胞中大量的Cap1,加上响应病毒感染诱导RIG-I表达,可以使Cap1 RNA成为RIG-I信号传导的重要激动剂。
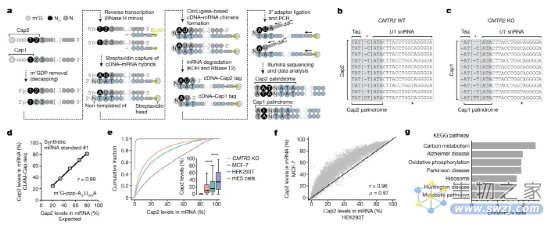
图2:CLAM-Cap-seq 鉴定特定 mRNA 上的 Cap2 甲基化富集。
先前的研究表明,RNA第一或第二位置的甲基化足以减少RIG-I的活化。研究人员发现Cap2中的双重甲基化功能降低了Cap1 RNA结合和激活RIG-I的能力。尽管研究人员的研究将RIG-I确定为Cap2的“反读取器”,但RIG-I KO并没有完全减少CMTR2耗尽后ISG的诱导。其他蛋白质,如IFITs或其他外来RNA传感器,如MDA5,也可能对 Cap2 甲基化敏感,因此调节 mRNA 生物学的各个方面。
值得注意的是,一些病毒已经获得了CMTR2同系物,例如Mimivirus和非洲猪瘟病毒。牛痘病毒中的CMTR同系物已被提出用于甲基化第一,第二和可能的其他核苷酸。因此,病毒CMTR同系物可能具有比以前认识到的更广泛的甲基化功能,包括Cap2甲基化,这可能有助于它们逃避宿主反应。
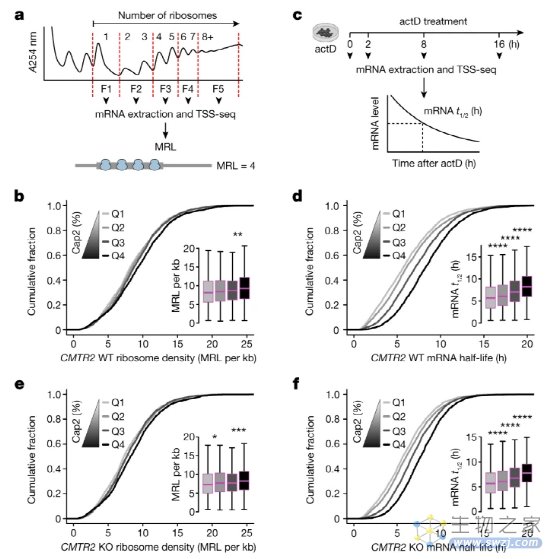
图3:Cap2甲基化在长寿命mRNA上高度富集。
Cap1和Cap2的水平在不同的细胞和组织中有所不同,这与CMTR2水平部分相关。虽然较高的Cap1水平可能对细胞有害,但研究人员发现这些细胞通常表现出较低的RIG-I表达,这可能会降低高水平的Cap1 RNA的自身炎症潜力。细胞可以调整CMTR2的水平以影响其对宿主或病毒RNA的细胞反应,并且Cap1的异常水平可能导致与先天免疫反应过度激活有关的疾病。
除了抑制细胞RNA的免疫刺激作用外,Cap2还可能以其他方式影响mRNA。研究人员的全球分析显示,Cap2对mRNA翻译或稳定性有微小但明显的影响。因此,Cap2可以塑造基因表达,特别是对于长寿命转录本,以进一步增强它们在细胞中的稳定性并增加它们的蛋白质表达。此外,一些RNA可能对Cap2有更强的依赖性,以防止它们与RIG-I的相互作用,因此可能在抑制Cap2修饰时的先天反应方面具有更重要的作用。其他RNA可能有助于Cap2的生物学,包括snRNA。最后,Cap2与果蝇的神经元功能有关,表明Cap2在低等生物中的不同作用。
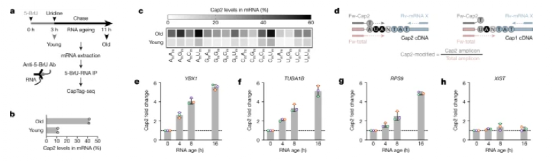
图4:Cap2是mRNA年龄的表观转录组标志。
研究人员开发了一套工具来分析和测量转录组和感兴趣的特定mRNA中的Cap2。使用CapTag-seq测量Cap1和Cap2帽标签揭示了批量mRNA中Cap2的总体患病率,而CLAM-Cap-seq涉及创建cDNA-cap标签嵌合体,这些嵌合体将mRNA的Cap2状态直接连接到由其产生的cDNA。随着新开发的生化和基于PCR的方法,可以轻松测量任何目标mRNA的Cap1或Cap2状态。
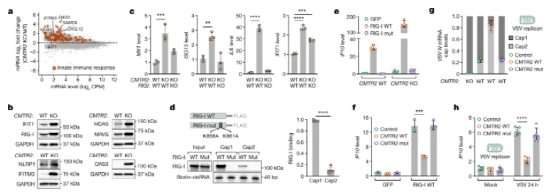
图5:Cap2甲基化抑制RIG-I活化和病毒诱导的先天免疫反应。
研究人员的数据显示,Cap2与其他表观转录组mRNA修饰有着根本的不同。首先,Cap2甲基化是一个动态过程,因为它在细胞质中mRNA的整个生命周期中不断积累。这与其他mRNA修饰形成鲜明对比,例如m6A,它们主要“写”在细胞核中,因此一旦mRNA离开细胞核,就很少或没有动力学潜力。尽管CMTR2对某些m的甲基化表现出轻微的偏好7G-近端序列,它不需要严格定义的序列基序。此外,Cap2的主要目的不是调节mRNA的命运,而是降低Cap1 RNA对旨在对抗入侵病原体的细胞内防御机制的总体负担。
原文链接:https://doi.org/10.1038/s41586-022-05668-z































