背景:
靶向传统T细胞的免疫疗法彻底改变了许多癌症的全身性治疗,但只有一部分患者从这些疗法中获益。我们需要更好地了解肿瘤复杂的免疫微环境,以设计下一代免疫疗法。固有淋巴样细胞(ILCs)和固有样T细胞(ILTCs)是大量存在于组织中的淋巴细胞,最近被证明在许多类型的癌症中发挥关键作用。ILCs和ILTCs对周围环境的变化迅速做出反应,并作为先天免疫和适应性免疫的第一个反应者。这使得ILCs和ILTCs成为最终抗肿瘤免疫反应的关键协调者。
简介:
2023年4月20日,来自美国国立癌症研究所,国立卫生研究院癌症研究中心的Firouzeh Korangy教授课题组在Nat Rev Cancer(IF: 69.8)杂志上发表题为“Innate lymphoid cells and innate-like T cells in cancer — at the crossroads of innate and adaptive immunity”的文章[1]。在本文中,作者概述了ILCs和ILTCs的特征,并讨论了它们在抗肿瘤免疫中的新作用,以及导致其促肿瘤功能的病理生理适应。作者探索了ILCs和ILTCs不同子集之间微妙相互作用的多效性(部分是多余的,有时是对立的)机制。最后,强调了它们在扩增和补充常规T细胞功能中的作用,并总结了针对ILCs和ILTCs的肿瘤免疫治疗策略。

主要结果:
固有淋巴样细胞(ILCs)
作为先天适应性连续体中“最先天”的细胞,ILCs是淋巴细胞的异质群体。它们代表T细胞的先天对应物,是先天免疫、炎症和组织修复的关键调节因子。ILCs主要是组织驻留细胞,感知周围微环境中的扰动,并通过分泌细胞因子迅速做出反应,使其成为协调有效免疫反应的第一响者之一。所有ILCs均不依赖重组激活基因(RAG),缺乏其他免疫细胞标志物的表达,因此被称为“谱系阴性”细胞。根据模拟TH细胞亚群的细胞因子和发育转录因子,ILCs被分为5类:NK细胞,ILC1s, ILC2s, ILC3s和LTi细胞。
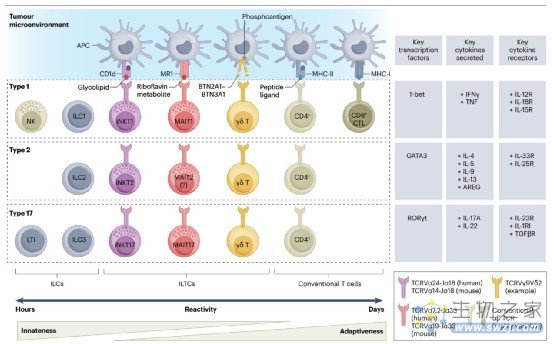
图1:肿瘤微环境中固有淋巴样细胞和固有样T细胞的亚群
ILCs和ILTCs在免疫监视中的作用
在肿瘤起始阶段,癌细胞产生细胞因子、趋化因子、警报素和造血生长因子以应对癌变,从而产生促肿瘤或抗肿瘤免疫。对恶性细胞的成功免疫监视需要组织驻留细胞和适应性免疫系统和固有免疫系统循环细胞的协调作用,以诱导有效的抗肿瘤反应。ILCs和ILTCs作为组织常驻淋巴细胞,在许多肿瘤部位大量存在,并通过同源受体感知细胞因子和警报素,促使促炎或组织保护因子的快速分泌,使其成为TME的第一反应者。在TME中,这些细胞的功能特性与环境相关,与关键共享的适应程序有关,以响应微环境。由肿瘤来源的信号和促炎细胞因子激活的平行途径可以触发ILCs和ILTCs的抗肿瘤转录谱。或者,有害的TME可能会提高它们在组织修复和稳态方面的潜力,导致它们向促进肿瘤的方向极化(图2)。决定促肿瘤或抗肿瘤功能的复杂性解释了为什么不同的临床和临床前研究将ILC和ILTC亚群与看似矛盾的结局关联起来。
抗肿瘤功能
ILCs和ILTCs对肿瘤的反应是环境依赖性的,因为在TME中释放的促炎细胞因子在这些细胞中诱导了独特的转录谱和特征性效应功能。利用基因缺陷小鼠或耗竭抗NK、iNKT和γδ T细胞抗体的大量体内研究表明,NK、NKT和γδ T细胞具有肿瘤保护作用。虽然这些细胞的功能通常可以跨越促进和破坏肿瘤的连续序列,但各自的细胞毒性ILC和ILTC亚群具备了一种有效的机制,可以限制肿瘤的生长和癌细胞的扩散。
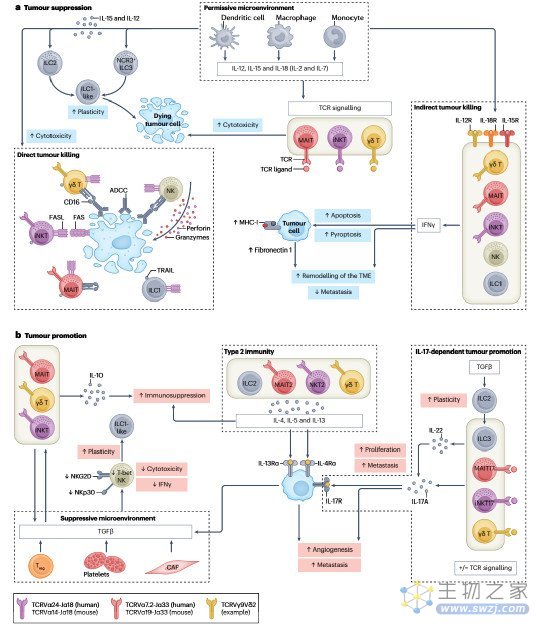
图2:平行和共享的途径主要是固有淋巴样和固有样T细胞的促肿瘤和抗肿瘤功能
桥接适应性和先天免疫
尽管ILC和ILTC可以作为肿瘤前或抗肿瘤免疫反应的直接效应细胞,但它们的主要功能是作为肿瘤免疫的协调者。这些细胞通过启动、放大、抑制或抑制TME中的免疫反应,在固有免疫和适应性免疫之间起桥梁作用。越来越清楚的是,ILCs和ILTCs在TME中受到炎症信号的影响而产生固有免疫应答。因此,ILCs和ILTCs参与了与固有免疫系统和适应性免疫系统以及微环境的复杂交互作用。反过来,固有免疫和适应性免疫相互调节ILCs和非常规T细胞,表明这样的细胞相互作用网络是组织内免疫应答的关键决定因素。
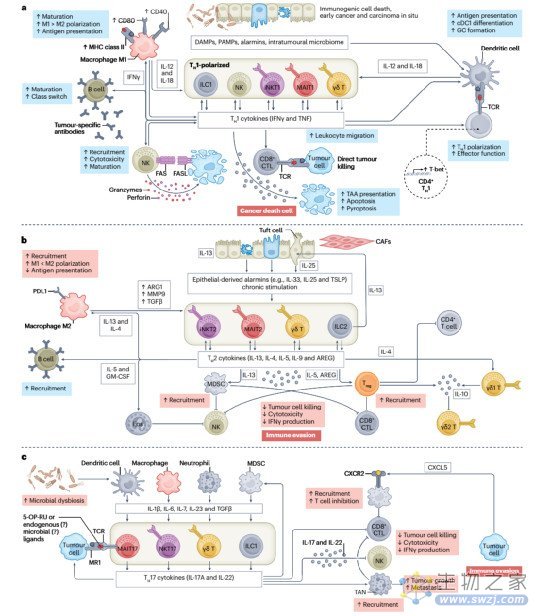
图3:固有淋巴样和固有样T细胞在癌症中桥接适应性和固有免疫中的作用
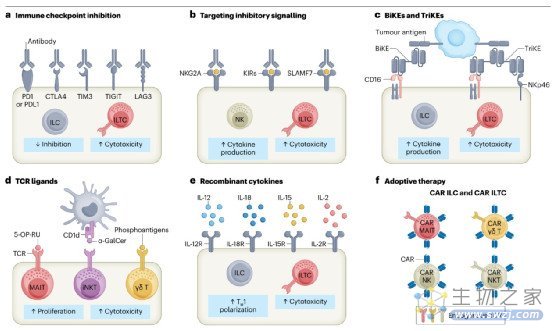
基于ILC和ILTC的肿瘤免疫治疗
传统的αβT细胞具有抗原导向的细胞毒性一直是肿瘤免疫疗法发展的主要焦点。然而,临床研究表明,很大一部分患者并没有从这些方法中获益。因此,有必要探索免疫系统参与对抗癌症的替代途径。NK细胞在肿瘤免疫监测中的重要性已经被认识多年,因此针对其进行肿瘤免疫治疗的各种临床研究正在进行中。相比之下,辅助性ILTCs和非常规T细胞直到最近才被认为是癌症免疫治疗中的重要参与者,因此针对这些细胞的免疫治疗方法还不太先进。随后,我们强调了ILCs和ILTCs作为癌症免疫治疗新靶点的潜力,以及利用其巨大潜力的未来方向(图4)。
免疫检查点抑制
通过抑制细胞毒性T淋巴细胞蛋白4 (CTLA4)和PD1-程序性死亡配体1 (PDL1)通路,对肽反应性常规T细胞进行靶向治疗,已彻底改变了许多类型癌症的治疗结果。与适应性细胞相似,癌症患者的ILCs和ILTCs也被发现上调其细胞表面免疫检查点分子的表达,如PD1, CTLA4, T细胞免疫球蛋白和黏蛋白分子3 (TIM3),T细胞免疫受体免疫球蛋白和ITIM结构域(TIGIT)和淋巴细胞活化基因3蛋白(LAG3)。
免疫受体的单克隆抗体
ILCs和ILTCs在人类肿瘤中过表达NKG2A,导致效应细胞受到抑制。人源化抗NKG2A单克隆抗体monalizumab已被证明可阻断NKG2A的抑制功能,目前正在实体瘤患者的数项2期试验中进行评估。
双特异性和三特异性杀伤细胞衔接器。
双特异性和三特异性杀伤衔接物(分别为BiKEs和TriKEs)是单克隆抗体片段,可在NK细胞上的激活性受体和肿瘤特异性抗原之间形成突触,从而最大限度地激活ILTCs和NK细胞。鉴于此,它们也被称为NK细胞衔接剂。将CD16和IL-15与肿瘤抗原(如CLEC12A、CD133或上皮细胞黏附分子)结合的BiKEs和TriKEs对患者来源的急性髓系白血病母细胞显示出强的NK细胞介导的应答。研究表明,三功能的NK细胞衔接器通过NKp46和CD16两种NK细胞受体靶向肿瘤抗原,在体外和小鼠淋巴瘤模型中均具有较高的疗效。ILCs和ILTCs可以通过其半不变受体特异性靶向到肿瘤部位,并增强其细胞因子分泌或细胞毒性。
以细胞因子为基础的免疫疗法
由于ILCs和ILTCs由许多重叠的细胞因子刺激,并且共享许多细胞因子受体,因此涉及细胞因子的免疫治疗方法可以共同靶向ILCs和ILTCs的亚群,从而触发重叠或协同机制。IL-2不仅在T细胞的存活和扩增中发挥作用,而且在不同的环境中诱导ILCs和ILTCs的扩增和活化。IL-2是最早用于增强NK细胞抗肿瘤功能的细胞因子之一;然而,由于不良反应和诱导Treg细胞,其疗效有限。IL-15在体外扩增和活化NK细胞和γδ T细胞的效率更高。IL-15单独或联合IL-12和IL-18通过上调穿孔素、颗粒酶和IFNγ的分泌增加细胞毒性。然而,持续使用IL-15诱导NK细胞的耗竭特征。
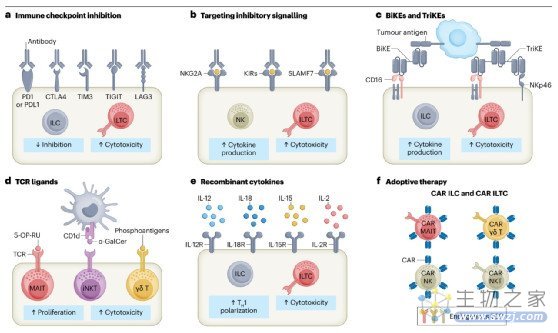
图4:利用固有淋巴样和固有样T细胞进行癌症免疫治疗的策略
结论和展望:
ILCs和ILTCs在组织中的高频率及其多效性效应功能使它们成为肿瘤免疫的主要调节者和关键协调者。由于肿瘤复杂而动态的微环境在肿瘤发生过程中被塑造,ILCs和ILTCs在肿瘤发生、免疫监视和肿瘤进展过程中作为TME的第一反应者,舞蹈着一个精心设计的程序。越来越明显的是,与传统T细胞不同,由于ILCs和ILTCs具有快速整合和对来自其环境的信号做出反应的能力,因此它们是免疫治疗策略的有吸引力的候选细胞。ILCs特别重要,因为它们具有高度的先天特点,因此反应最迅速。
我们需要开展更多研究,以进一步了解和描述影响ILCs和ILTCs的调控机制,以及ILCs指导的和ILTCs指导的疗法的临床后果,从而批准它们作为现货或通用药物。考虑到ILC亚群既依赖于组织又依赖于肿瘤类型,因此识别出更好地区分小鼠和人类ILC亚群的其他标志物也将有助于开发更好的靶向疗法。此外,使用基因工程小鼠和开发在小鼠模型中操作这些细胞的工具对于免疫治疗干预具有重要意义。
原文链接:https://www.nature.com/articles/s41568-023-00562-w
参考文献:
[1] Ruf B, Greten TF, Korangy F. Innate lymphoid cells and innate-like T cells in cancer - at the crossroads of innate and adaptive immunity. Nat Rev Cancer. 2023 Apr 20. doi: 10.1038/s41568-023-00562-w. Epub ahead of print. PMID: 37081117.































