与正常细胞相比,异常生长,过度增殖的肿瘤细胞往往需要更多的能量。因此,“饿死”肿瘤细胞是一种颇具吸引力的肿瘤治疗方式。通过抑制肿瘤血管生成[1]、干扰肿瘤细胞获取葡萄糖功能[2]等,可阻碍肿瘤细胞能量供给,进而诱导其死亡,这已成为一种重要的肿瘤治疗手段。
然而现实似乎并不如预期那般顺利,狡猾的肿瘤细胞在饥饿环境下利用肿瘤微环境以获取额外的营养来满足其生长[3]。免疫细胞、成纤维细胞和内皮细胞在内的多种微环境细胞类型均可以被肿瘤细胞重新驯化,为其提供足够代谢底物。然而,作为肿瘤微环境的重要组成成分,周围神经是否参与其中,仍是个谜题。
以疼痛和神经侵袭(PNI)为显著特征的口腔鳞状细胞癌(OSCC),或许可以给我们答案。近日,上海交通大学季彤、王旭及孙树洋联手合作,在Cell Metabolism发表了他们的研究成果,破解这一谜题。
他们发现,OSCC肿瘤微环境中具有高密度的肿瘤相关伤害性感觉神经,肿瘤细胞可以利用伤害性感觉神经产生的神经源性肽,支持自己在饥饿环境中的成长,破坏肿瘤细胞和伤害性神经之间的相互作用,可以有效提高饥饿疗法的抗肿瘤效果[4]。

论文首页截图
OSCC是一种具有高度糖酵解活性的恶性肿瘤,并通过诱导广泛的血管生成以获取生长所需营养。然而,抗糖酵解[5]和抗血管生成疗法[6]疗效并不理想,这表明肿瘤细胞可通过其他方式获取营养。而伤害性感觉神经(即痛觉感觉神经)在其中的作用,则引起了季彤、王旭及孙树洋等人的注意。
研究人员首先发现,OSCC中具有高密度的伤害性神经浸润。其次,作为神经细胞产生伤害感受活动的分子指标,降钙素基因相关肽(CGRP)阳性神经比例较高的患者的总生存率(OS)较差。这表明肿瘤相关伤害性神经及其生物学活性在OSCC进展过程中发挥重要作用。
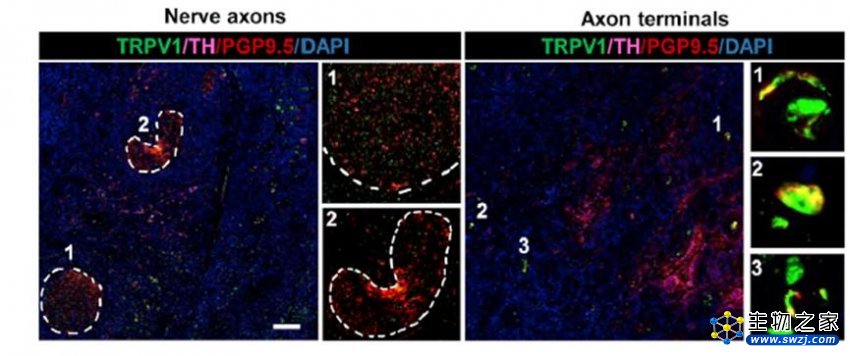
OSCC中具有较高密度的伤害性感觉神经(TRPV1阳性)
研究人员进一步建立了小鼠舌异种移植瘤模型。在异种移植物中均可检测到高比例的CGRP阳性神经。在去除伤害性去神经元后,小鼠舌异种移植物明显减小,表明伤害性神经有助于肿瘤的生长。
那么OSCC中伤害性神经是如何促进肿瘤生长的呢?
为了解答这一迷惑,研究人员首先构建共培养模型开展了体外实验。出乎意料的是,在常规高糖培养条件下,与对照组相比并未观察到肿瘤细胞生长显著变化。
体内和体外实验差异使研究人员认识到,肿瘤微环境成分可能会影响肿瘤细胞和伤害性神经之间的调节作用。他们先是通过免疫缺陷鼠的实验排除了免疫细胞在其中发挥的作用。随后通过对TCGA基因表达数据分析发现,OSCC中葡萄糖消耗量明显高于正常组织和其他部位的肿瘤。有趣的是,当OSCC处于低葡萄糖条件下时,伤害性神经明显促进了肿瘤细胞增殖。
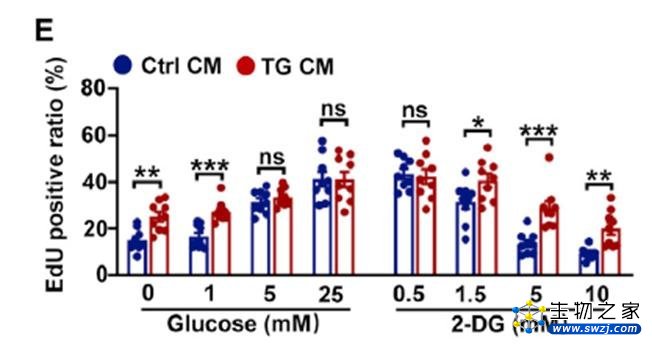
低葡萄糖条件下伤害性神经促进肿瘤细胞生长
接下来,研究人员通过人为改变小鼠异种移植肿瘤中的葡萄糖含量,或通过遗传学手段抑制神经活动,均再次证明伤害性神经介导的促生长效应取决于低葡萄糖环境。
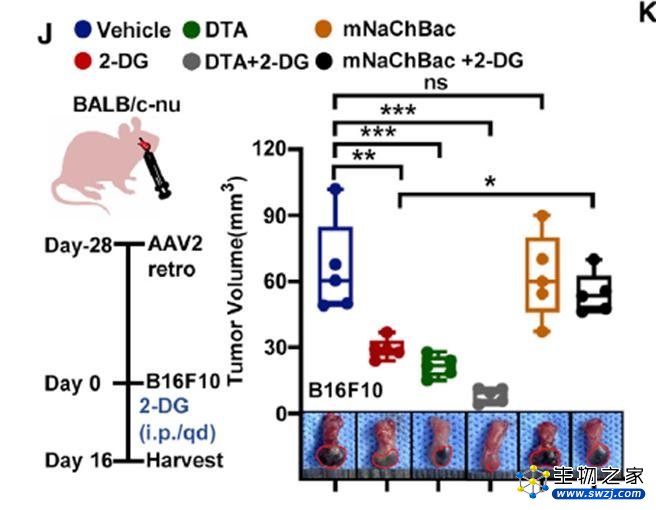
伤害性神经介导的促肿瘤生长效应依赖于低葡萄糖环境
神经细胞可以释放许多分子,包括代谢产物、活性蛋白和核酸等,究竟是哪一个在伤害性神经调节肿瘤进展中发挥作用呢?
基于一系列研究结果,研究人员发现,是活性蛋白在伤害性神经的生长促进作用中起主要作用。
而刚才提到的CGRP,便是伤害性神经分泌的主要活性蛋白。于是,研究人员使用CGRP受体拮抗剂Rimegepant处理细胞,或人为干扰肿瘤细胞中CGPR受体CLR或RAMP1的表达,发现可以拮抗伤害性感觉神经对肿瘤细胞的促生长作用。这表明,在低葡萄糖环境中,伤害性神经对肿瘤细胞的促进作用依赖于神经源性CGRP。
进一步体内实验表明,肿瘤内注射重组人CGRP(rhCGRP),可挽救由伤害性神经缺失所介导的肿瘤抑制作用。此外, 将CGRP编码基因条件敲除能够显著抑制低葡萄糖环境中肿瘤进展,而CGRP的条件性过表达则具有相反的结果。这些结果再次证明,神经源性CGRP介导低糖环境中伤害性神经对肿瘤细胞的促进作用。
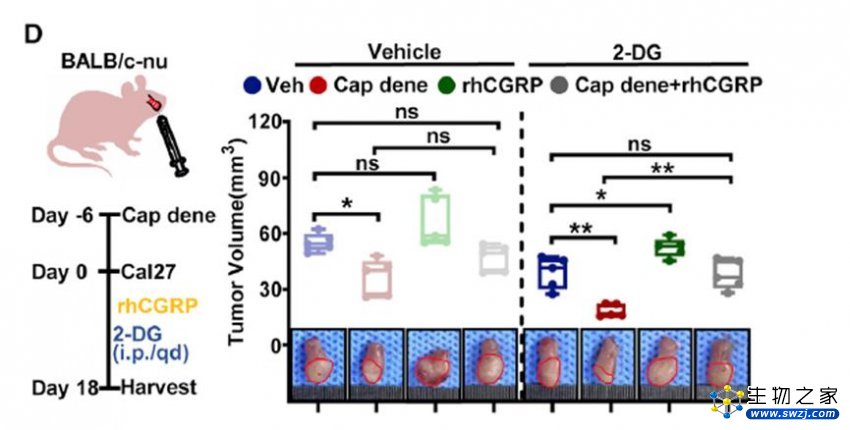
伤害性神经对肿瘤细胞的促进作用依赖于神经源性CGRP
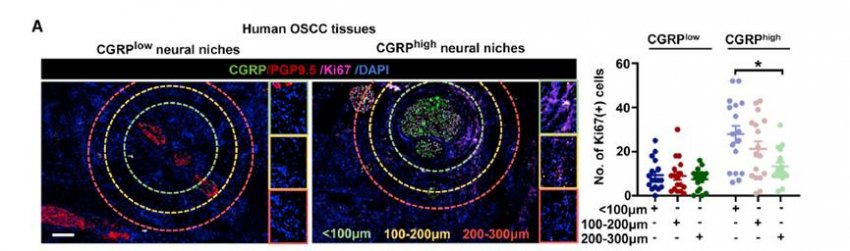
GCRP表达与Ki67+肿瘤细胞的比例具有较高一致性
从机制上来看,研究人员发现在低葡萄糖环境中,神经源性CGRP可诱导肿瘤细胞发生保护性自噬。CGRP 可以激活肿瘤细胞内Rap1以阻碍Raptor-mTOR的相互作用,从而促进肿瘤细胞在乏糖环境下的细胞保护性自噬。
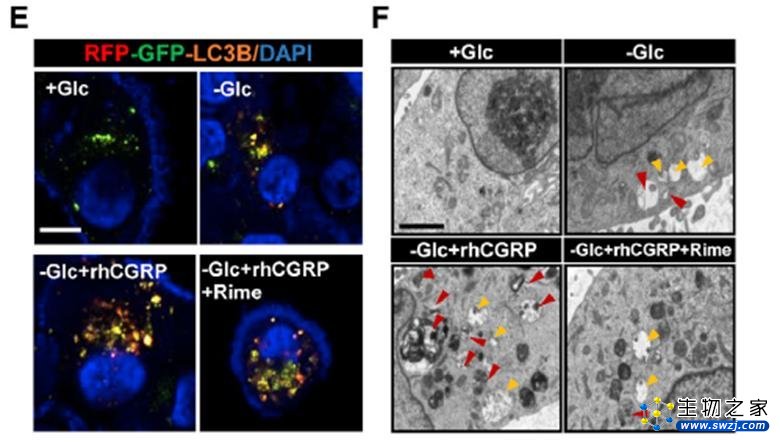
神经源性CGRP诱导肿瘤细胞自噬
接下来有必要考虑的问题是,肿瘤细胞是如何影响伤害性神经分泌CGRP的呢?
研究人员发现,在低葡萄糖条件下,肿瘤细胞中神经营养因子NGF水平显著升高,而肿瘤细胞衍生的NGF可促进伤害性神经中CGRP的分泌。如果使用NGF受体TrkA的选择性抑制剂GW-441756处理,即可阻断CGRP分泌的增加。也就是说,在低葡萄糖环境中,肿瘤细胞通过NGF促进伤害性神经中CGRP的分泌。
研究人员进一步将c-Jun确定为NGF的潜在调节因子。低葡萄糖环境下肿瘤细胞中的ROS水平显著升高,激活JNK-c-Jun通路活化的c-Jun进一步激活NGF转录。
这种低葡萄糖环境中癌细胞和伤害性神经之间的双向相互作用启发研究人员,破坏这种恶性循环可能会加强肿瘤饥饿疗法的疗效。因此,CGRP受体拮抗剂Rimegepant或许是新的协同治疗药物。
为验证这一猜测,研究人员首先使用糖酵解抑制剂WZB117、Fasentin、Lonidamine和血管生成抑制剂安罗替尼处理肿瘤细胞,发现这些药物显著增加了人舌鳞癌细胞(Cal27)中的NGF水平,以及伤害性感觉神经中CGRP水平。这表明,抗糖酵解和抗血管生成的饥饿疗法加剧了肿瘤细胞和伤害性神经之间的恶性循环。
接下来,研究人员将这些药物与Rimegepant联合应用治疗小鼠异种移植瘤,结果显著减少了舌异种移植瘤的大小。
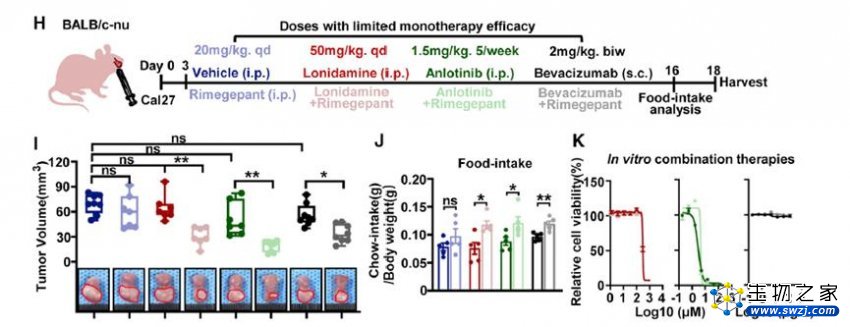
Rimegepant与肿瘤饥饿疗法具有协同作用
进一步组织学分析显示,联合治疗抑制了肿瘤细胞增殖和自噬,表明用Rimegepant破坏癌细胞和伤害性神经之间的相互作用,可以有效提高营养缺乏疗法的抗肿瘤效果。
总之,通过上述研究,季彤、王旭及孙树洋等人揭示,肿瘤细胞可以借助伤害性神经以满足自身在营养不良的环境中的生长。同时,通过阻断肿瘤细胞与伤害性神经的相互作用,可以与当前的抗糖酵解或者抗血管生成疗法产生协同作用,为OSCC的治疗提供了新的思路。
参考文献:
[1] Marx J. Angiogenesis. A boost for tumor starvation[J]. Science, 2003, 301 (5632):452-454. DOI:10.1126/science.301.5632.452.
[2] Stine ZE, Schug ZT, Salvino JM, et al. Targeting cancer metabolism in the era of precision oncology[J]. Nat Rev Drug Discov, 2022, 21 (2):141-162. DOI:10.1038/s41573-021-00339-6.
[3] Pavlova NN, Zhu J,Thompson CB. The hallmarks of cancer metabolism: Still emerging[J]. Cell Metab, 2022, 34 (3):355-377. DOI:10.1016/j.cmet.2022.01.007.
[4] Zhang Y, Lin C, Liu Z, et al. Cancer cells co-opt nociceptive nerves to thrive in nutrient-poor environments and upon nutrient-starvation therapies[J]. Cell Metab, 2022. DOI:10.1016/j.cmet.2022.10.012.
[5] Abdel-Wahab AF, Mahmoud W,Al-Harizy RM. Targeting glucose metabolism to suppress cancer progression: prospective of anti-glycolytic cancer therapy[J]. Pharmacol Res, 2019, 150:104511. DOI:10.1016/j.phrs.2019.104511.
[6] Hyytiäinen A, Wahbi W, Väyrynen O, et al. Angiogenesis Inhibitors for Head and Neck Squamous Cell Carcinoma Treatment: Is There Still Hope?[J]. Front Oncol, 2021, 11:683570. DOI:10.3389/fonc.2021.683570.































