
Tau蛋白的异常聚集是多种神经退行性疾病的发病原因【1】。细胞外的tau蛋白聚集体会与细胞表面蛋白聚糖以及低密度脂蛋白受体相关蛋白LRP1相互作用形成tau蛋白池的聚集种子【2】。研究表明tau抗体可以减少tau蛋白在动物模型中的病理作用,在人体中对于神经退行性疾病的治疗作用也正在研究之中【3】。但是tau抗体中和作用对神经元保护作用机制尚不清楚,其中通过细胞表面抗体受体Fc- γ通过阻断tau种子进入细胞或者促进tau聚集体被送去溶酶体降解等机制是比较有潜力的模型。胞质抗体受体与E3泛素连接酶TRIM21简称T21能够与细胞中抗体结合的蛋白粒子结合,并在促进蛋白酶体降解反应。然而T21在tau蛋白免疫治疗中的贡献仍不可知。为此,英国剑桥大学William A. McEwan研究组与Aamir S. Mukadam(第一作者)合作在Science上发文题为Cytosolic antibody receptor TRIM21 is required for effective tau immunotherapy in mouse models,发现TRIM21会促进tau病理性聚集体的免疫治疗,为神经退行性疾病的免疫治疗方法提供了新的设计。

为了对tau蛋白种子形成后T21在其中的作用进行解析,作者们首先检测抗体能能否被tau蛋白聚集体结合进入神经元。作者们对重组兔单抗BR134-tau进行孵育,8个小时后可以发现tau聚合体出现在细胞之中,说明BR134抗体并不能阻止tau聚集体进入细胞之中。当BR134存在的时候,tau聚集体会与T21 共定位。因此,作者们发现tau蛋白聚集体在抗体存在情况下可以进入神经元的胞质之中,且是一种依赖于抗体Fc区域与T21二聚体结构域之间的高亲和力相互作用。
随后作者们对T21 在中和tau种子聚集体中的作用进行检测。为此,作者们使用了器官海马区切片培养tau蛋白种子模型【4】。切片上准备了表达人聚集体形成突变型P301S Tau-Tg转基因小鼠脑片,并且在气-液培养基表面进行培养。作者们发现BR134的孵育会降低超过90%的tau聚集体的形成。但是在敲除T21后,BR134对于聚集体的清除能力则大大下降(图1)。
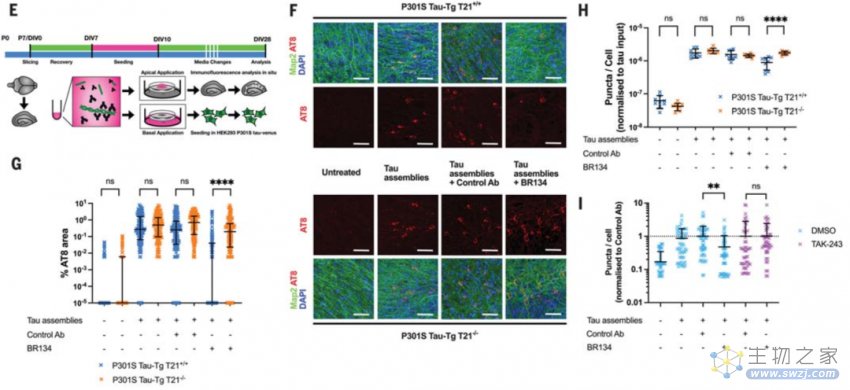
图1 内源T21保护神经元中Tau聚集体清除过程
进一步地,作者们在人诱导多能干细胞分化而来的神经元中对T21的功能进行检测。作者们使用5型腺病毒AdV检测T21 的活性,发现使用抗腺病毒鼠单克隆抗体9C12能够中和腺病毒的感染,并且这一过程依赖于T21。通过在T21与Fc结合表面引入突变型氨基酸会使得该中和作用丧失。因此,作者们发现T21在人神经元中表达并激活,会参与到免疫治疗的过程中。
随后,作者们希望对T21 在tau病理转基因模型中的作用进行检测。在P301S转基因小鼠中形成不可溶的tau并形成tau种子,作者们对小鼠进行AP422抗体处理。作者们发现在T21+/+动物中,tau聚集体降低了85%。但是在T21-/-动物中AP422抗体的保护作用则消失(图2)。因此,在动物模型中抗体对于tau聚集体清除作用需要T21。
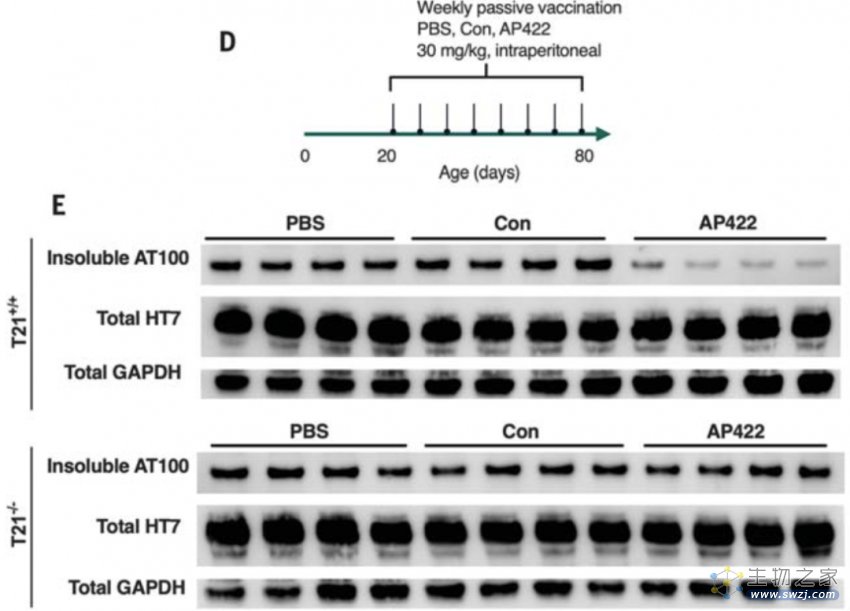
图2 T21 为tau病理聚集体清除提供免疫保护
总的来说,作者们的工作证明使用抗体免疫疗法治疗tau聚集体引发神经退行性疾病需要内源TRIM21受体的存在,这一细胞内抗体受体为免疫治疗的效果保驾护航。这一证据将为神经退行性疾病抗体依赖的治疗方案提供新的设计。
原文链接:http://doi.org/10.1126/science.abn1366
参考文献
1. M. Goedert, FEBS Lett. 592, 2383–2391 (2018).
2. F. Clavaguera et al., Nat. Cell Biol. 11, 909–913 (2009)
3. K. Yanamandra et al., Neuron 80, 402–414 (2013)
4. L. V. C. Miller et al., Acta Neuropathol. Commun. 9, 41 (2021)































