前言
免疫系统与肿瘤之间的关系是目前癌症领域研究最多的课题之一。以前,人们认为癌症仅肿瘤本身的作用;然而,现在我们知道它需要不同细胞和细胞因子的支持,即肿瘤微环境(TME)。在构成TME的成分中,负责支持肿瘤的免疫细胞,在这种肿瘤环境中起着关键作用。虽然在正常情况下,免疫细胞可以在癌症免疫监测过程中识别和摧毁新生的肿瘤细胞,但在癌症免疫编辑过程中,它们可能会受到肿瘤存在的不同因素的影响。免疫细胞可以充当监护人(抗肿瘤免疫)或肿瘤的旁观者或支持者(促肿瘤免疫),这一事实使它们成为TME中的一把“双刃剑”。
肿瘤微环境
长期以来,几乎所有的研究都只专注于单个肿瘤细胞,人们认为肿瘤是由增殖的癌细胞组成的组织肿块;然而,在19世纪,Stephen Paget通过种子和土壤理论对TME的描述证实了肿瘤包含各种非癌细胞。在过去25年中,肿瘤作为一个复杂的器官进行了研究,表明整个肿瘤成分(肿瘤细胞)本身不是恶性的,但它们需要肿瘤基质(非肿瘤细胞)的作用来促进肿瘤的发生,包括持续的炎症。事实上,在其初始阶段,肿瘤细胞能够指导TME形成血管,以招募营养因子、细胞衍生囊泡和免疫细胞,从而促进许多癌症特征的发展。
构成TME和肿瘤细胞的肿瘤基质包括基底膜、细胞外基质(ECM)、成纤维细胞、各种癌症相关成纤维细胞(CAF)、血管生血管细胞(AVC)、内皮细胞、支持粘液细胞、胶质细胞、平滑肌、上皮细胞、,脂肪细胞和浸润性免疫细胞(IIC)。此外,TME还含有细胞因子、趋化因子、生长因子和抗体。
TME如何影响肿瘤发生、癌症进展和转移的研究越来越多。目前,已有的研究表明,肿瘤可以改变其微环境,而微环境可以影响肿瘤的生长和扩散。TME在调节癌症患者的免疫反应中起着关键作用。肿瘤细胞及其微环境通常会产生大量免疫调节分子,这些分子会对免疫细胞的功能产生负面(抑制因子)或正面(激活因子)影响。因此,TME能够根据TME的组成将免疫反应从肿瘤破坏性模式转换为肿瘤促进模式。其中,TME中的免疫细胞、可溶性介质(细胞因子、趋化因子、血管生成因子、淋巴管生成因子和生长因子)和细胞受体在免疫反应中起着关键作用。
TME中免疫细胞的双重作用
免疫细胞包括不同的细胞群:白细胞分为粒细胞(中性粒细胞、嗜酸性粒细胞和嗜碱性粒细胞)、单核细胞和淋巴细胞(T淋巴细胞和B淋巴细胞),还有红细胞、血小板、肥大细胞、树突状细胞(DC)和固有淋巴细胞(ILC)。所有这些细胞都来源于骨髓中的造血干细胞(HSC)。
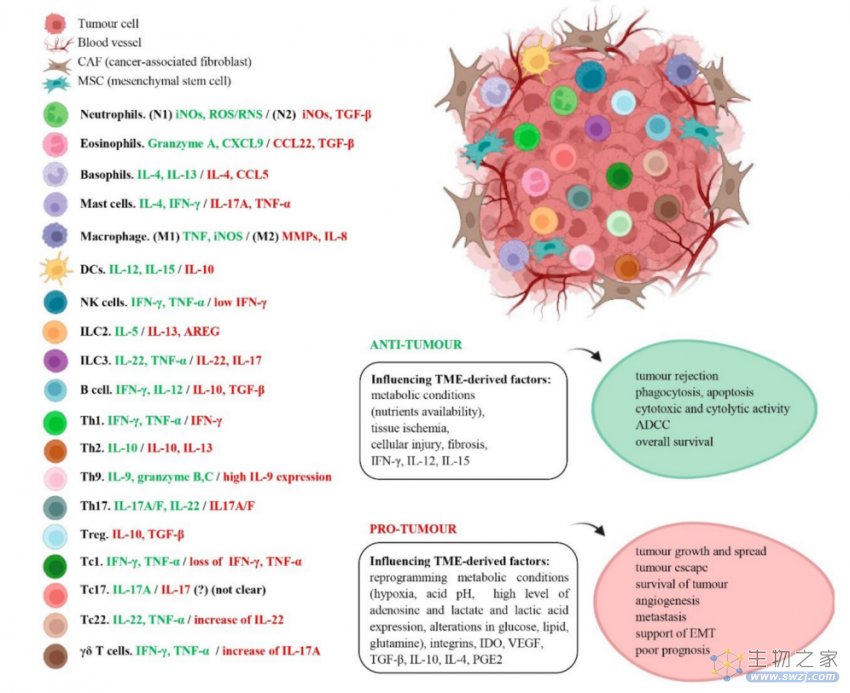
在涉及的因素中,肿瘤源性细胞因子、趋化因子甚至代谢条件(pH、氧气水平和营养素)都可以影响TME中的免疫细胞功能。根据TME的不同,免疫细胞将相应地分泌不同的因子,从而确定其抗肿瘤或促肿瘤作用。
粒细胞
多项研究表明,TME中的肿瘤相关中心粒细胞(TAN)促进肿瘤细胞的增殖、外渗和迁移。TAN可释放颗粒成分,如弹性蛋白酶,以促进癌细胞的增殖和侵袭。TAN还通过分泌IL-1β和MPPs促进肿瘤细胞向转移前龛的外渗,从而促进癌细胞的扩散。除了促肿瘤作用外,TAN还通过产生ROS和TRAIL来介导肿瘤细胞的细胞毒性。
具有抗肿瘤作用的中性粒细胞被称为“N1”TAN,而具有促肿瘤作用的中性粒细胞被称为“N2”TAN。研究表明,TME通过分泌各种细胞因子影响N1和N2亚群的平衡,例如,TGF-β、IL-6、G-CSF和IL-35可诱导TAN的促肿瘤极化,IFN-β和IL-12可诱导TAN的抗肿瘤极化。研究还表明,TAN与TME中的淋巴细胞相互作用并调节其功能。在4T1荷瘤小鼠中,N2 TAN抑制NK细胞介导的肿瘤细胞清除,从而促进肿瘤转移。N2 TAN还通过分泌CCL17将Treg招募到TME中,从而促进肿瘤生长。相反,N1 TAN产生趋化因子,如CCL3、CXCL9、CXCL10,将CD8+T细胞招募到TME中,并分泌细胞因子(如IL-12、TNF-α和GM-CSF),以激活CD8+T细胞的细胞毒性,从而提供抗肿瘤作用。
肥大细胞
肿瘤相关肥大细胞(TAMC)在人类实体瘤中的预后价值尚不清楚,且存在争议。然而,众所周知,MCs通过释放IL-1、IL-4、IL-6、IL-8、TNF-α、IFN-γ、TGF-β、MCP-3、MCP-4、白三烯B4(LTB4)和糜蛋白酶,可促进炎症、抑制肿瘤细胞生长和诱导肿瘤细胞凋亡。此外,在肺癌小鼠模型中,前列腺素D2(PGD2)分泌与抑制血管生成和血管通透性相关。目前,已知它们与一些人类癌症的良好预后相关,如非小细胞肺癌、乳腺癌和前列腺癌。
当作为促肿瘤细胞激活时,TAMC能够促进:(1)肿瘤细胞的增殖和存活;(2) 通过分泌血管生成成分,包括IL-8、TNF-α、TGF-β、神经生长因子(NGF)、VEGF、成纤维细胞生长因子(FGF-2)和尿激酶型纤溶酶原激活剂(uPA),实现血管生成和淋巴管生成;(3) 通过释放MMP、类胰蛋白酶和糜蛋白酶促进侵袭和转移;(4) TME免疫抑制。有趣的是,在这种情况下,肿瘤内MCs与不良预后相关。它们具有促肿瘤活性,因为它们能够通过表达显著更高水平的免疫抑制分子PD-L1来破坏人类胃癌的抗肿瘤免疫,从而抑制T细胞免疫。因此,在CRC患者、胃癌、PDAC、乳腺癌、肺癌和前列腺癌患者中,MCs与较差的预后相关
巨噬细胞
肿瘤相关巨噬细胞(TAM)在功能上是异质性的,分为两个主要亚群,M1和M2巨噬细胞。在对脂多糖(LPS)、IFN-γ和GM-CSF的反应中,M1巨噬细胞经历经典激活并优先分泌抗菌分子和促炎细胞因子,包括活性氧(ROS)、一氧化氮(NO)和IL-6。M1巨噬细胞是抵抗微生物感染的第一道防线。M1巨噬细胞还保持强大的抗原呈递能力,诱导强烈的Th1反应。
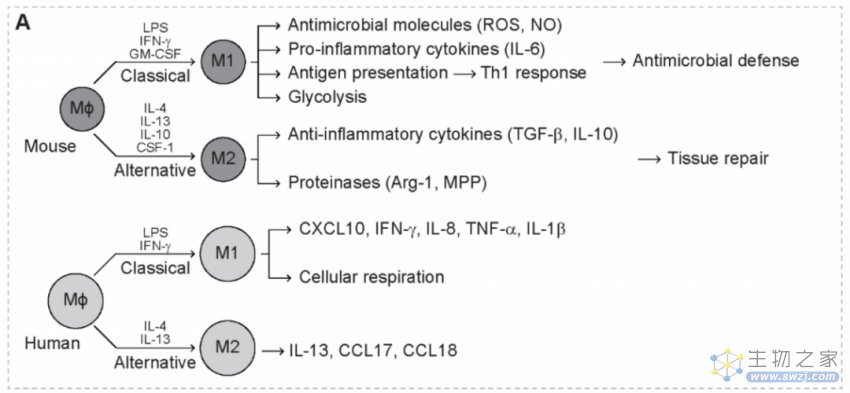
相反,M2巨噬细胞受IL-4、IL-13、IL-10和CSF-1的作用经历选择性激活,并优先分泌抗炎细胞因子,包括转化生长因子β(TGF-β)、IL-10以及蛋白酶(如精氨酸酶-1和MPPs)。M2巨噬细胞在限制免疫反应、诱导血管生成和组织修复方面起着关键作用。因此,M2样TAM的存在与促肿瘤活性相关,而M1样TAM的存在与抗肿瘤活性相关。
TAM通过分泌促炎症介质,如TNF-α和ROS,创造有利于肿瘤启动的诱变微环境。
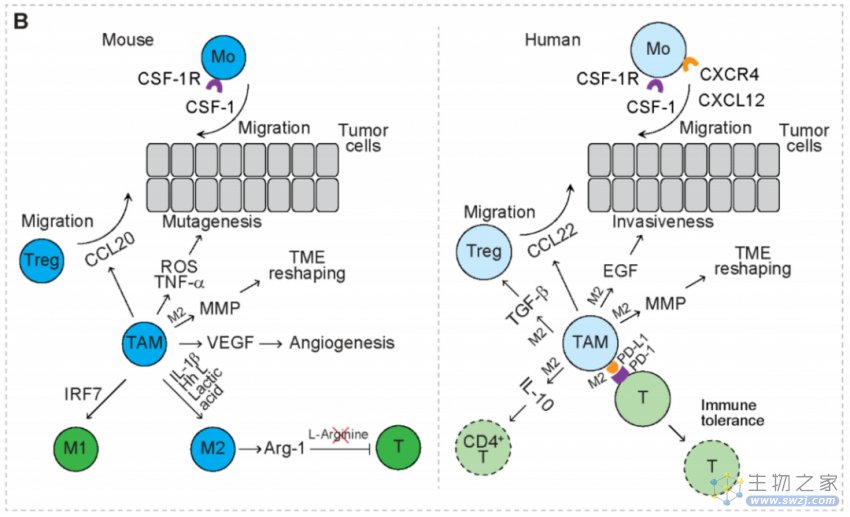
在非小细胞肺癌患者中,免疫检查点配体PD-L1的表达在肿瘤浸润性免疫细胞中上调,其中富含M2样TAM。机理研究表明,暴露于乳酸后,TAMs上PD-L1的表达上调。PD-L1与T细胞上PD-1的相互作用抑制了T细胞增殖并诱导T细胞凋亡,从而导致免疫耐受。同时,TAM通过表达PD-L1和分泌抗炎细胞因子IL-10抑制CD4+辅助性T细胞的扩增。
另外, TAM通过分泌趋化因子CCL22以招募Treg,通过分泌TGF-β,来增强Treg的功能。人类TAM还分泌表皮生长因子(EGF)以增强肿瘤细胞的侵袭性。TAM均上调MMP,MMP降解间质胶原,上调胶原的合成和组装,以重塑TME,有利于肿瘤细胞的侵袭。
树突状细胞
树突状细胞是最有效的抗原呈递细胞(APCs),连接先天免疫和适应性免疫。DC在生理条件下具有表型和功能异质性。作为对微生物感染的反应,细胞外微生物蛋白通常被成熟DC吞噬或内吞,并通过II类主要组织相容性复合体(MHC)分子呈现给CD4+T细胞。相反,胞浆微生物蛋白通常通过I类MHC分子呈现给CD8+T细胞。渗透到TME中的DC包括处于不同发育阶段的不同亚群。这些肿瘤相关树突状细胞根据树突状细胞亚群和肿瘤分期发挥免疫刺激或免疫抑制作用。
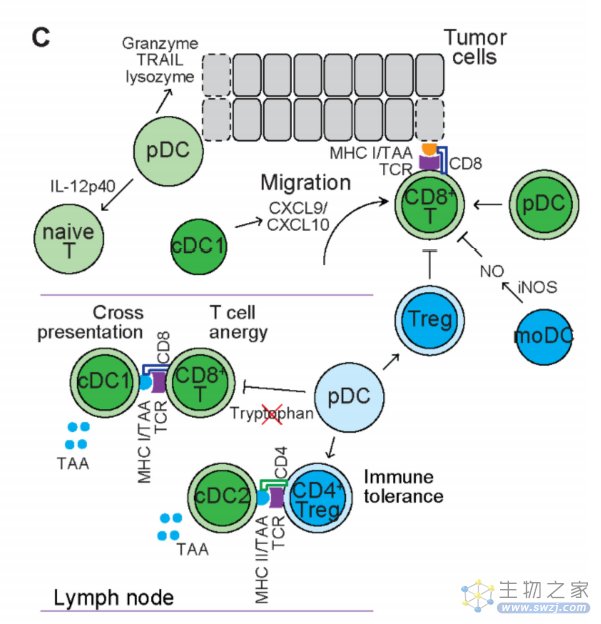
传统DC(cDC):cDC由两个表型和功能不同的亚群组成。人cDC1表达CD11c、MHC-II、BDCA3、CD141、XCR1、CLEC9A和DNGR1。人cDC1表达toll样受体(TLR)并分泌促炎性细胞因子,包括IL-12p70和IFN-α,以响应感染诱导Th1反应。cDC1刺激抗肿瘤免疫反应,cDC1特异性基因标记一直被用作癌症患者的积极预后标志物,cDC1在肿瘤中的存在与良好的临床结果相关。
cDC2更丰富,表达CD11c、MHC-II、BDCA1、CD172a(SIRPα)、CD115(CSF-1R)和CD11b。人cDC2产生各种细胞因子,如IL-10和IL-23,并将抗原呈递给CD4+辅助性T细胞,从而激活效应性T细胞,包括Th2细胞和Th17细胞。cDC1启动dLN不同区域的CD8+T细胞,而cDC2启动dLN不同区域的CD4+T细胞。尽管cDC2激活的效应T细胞主要是导致免疫耐受的Treg但在人类和小鼠模型中,cDC2基因标记的表达与阳性预后相关。因此,cDC1和cDC2都有利于抗肿瘤免疫。
浆细胞样DC(pDC): 与分泌抗体的浆细胞具有相同形态的DC称为pDC。人pDC为CD123+CD303+CD304+CD11c?, 在应对病毒感染时,pDC通过TLR识别病毒核酸,分泌I型干扰素IFN-α,并在抗病毒防御中发挥关键作用。然而肿瘤浸润性pDC会导致IFN-α的减少并维持了体内FoxP3+Tregs的扩增,促进了免疫耐受和肿瘤的进展。此外,黑色素瘤患者中的pDC表达吲哚胺2,3-双加氧酶,可消耗色氨酸, 导致T细胞无能和免疫耐受。表明pDC可诱导免疫抑制性免疫反应。
除了免疫抑制作用外,一些研究表明pDC可诱导免疫刺激反应。CD123+pDC位于原发性黑色素瘤的瘤周区域,与CD8+T细胞密切接触。功能分析显示,人和小鼠pDC均能激发CD8+T细胞,导致其活化并分化为细胞溶解性和产生IFN-γ的效应T细胞,并使体内肿瘤消退。
TME的人CD2highpDC表达高水平的颗粒酶B、TRAIL和溶菌酶,限制肿瘤细胞的增殖并介导肿瘤细胞的接触依赖性杀伤。此外,CD2highPDC也能有效分泌IL-12p40,它能刺激幼稚T细胞,导致T细胞扩增和免疫反应。因此,pDC在肿瘤发展过程中既发挥促肿瘤作用,又发挥抗肿瘤作用。
单核细胞源性DC(MoDC): 作为对感染的反应,循环单核细胞进入组织并分化为DC, 这些DC称为MoDC或炎性DC(inf DC),在人类中表达CD1a、BDCA1、CD11c、MHC II和CD64。在某些癌症的TME中观察到MoDC,MODC能够有效表达TNF-α和诱导型一氧化氮合酶(iNOS), iNOS介导产生的NO抑制T细胞增殖,表明MoDCs诱导免疫抑制反应。此外,在淋巴瘤小鼠模型中,过继转移的CD8+T细胞介导的抗肿瘤作用依赖于DC表达的一氧化氮合酶2(NOS2),提示MODC具有免疫刺激作用。因此,MoDC在肿瘤中的功能需要进一步研究。
NK细胞
NK细胞可以自发发挥作用,而无需事先致敏。此外,它们在细胞触发时快速产生IFN-γ和TNF-α的能力,导致对致癌转化的早期反应。因此,其对肿瘤细胞的即时干预,包括其促进炎症发生的作用,与它们积极参与肿瘤的免疫监测有关。
NK细胞通过其细胞毒性反应参与溶瘤作用,NK细胞的效应免疫反应涉及多种细胞因子(IFN-γ、IL-10、IL-5、IL-13、TNF-α和GM-CSF)和趋化因子(MIP-1α、MIP-1β、IL-8和CCL5)的分泌。值得注意的是,NK细胞表达的CD96、CD161和CD244等分子可以作为共受体,调节细胞溶解活性和细胞因子的产生,IFN-γ是NK最常见的细胞因子之一,是NK通过激活其表面受体NKG2D分泌的,在抗肿瘤活性中起着关键作用。
尽管NK细胞在抗肿瘤活性方面的贡献众所周知,但由于TME试图逃避NK细胞监测的影响,它们可以被调节并表现为促肿瘤表型。其作为促肿瘤细胞的作用机制与免疫编辑和免疫抑制有关。
一方面, TME对NK受体有影响,一项研究表明,中和TME恢复了NK细胞的细胞毒性活性,增强了NKG2D的表达;另一方面, TME通过耐受性免疫细胞(如Treg、MDSCs、TAMs)以及可溶性因子(如PGE2、TGF-β、IL-6等)诱导免疫抑制环境,这些都会导致NK细胞的功能障碍。在这种情况下,TME的免疫抑制作用会导致NK细胞以促肿瘤的方式发挥作用,有研究在一些CRC患者中报告此类情况。
B细胞
自20世纪70年代以来,人们普遍认为B细胞只具有促肿瘤功能,因为在一些小鼠模型中,B细胞抗体的行为可能有利于癌症的发生和扩散。然而,近年来,进一步的研究显示了其在抗肿瘤免疫中的作用。事实上,在对54个癌症研究的分析中,有50%的研究报告对肿瘤浸润性B细胞的预后影响呈阳性,其余9%为不良,41%中性。在转移性黑色素瘤中,TIL B细胞被认为是仅次于CD8+TIL的第二个最佳疾病预后预测因子。此外,TILs B细胞还能够在癌症环境中表现出抗原驱动的克隆扩增、类别转换和亲和力成熟。
TIL B细胞和肿瘤内产生的抗体可通过以下机制促进抗肿瘤活性:(1)向CD4+和CD8+T细胞呈递肿瘤源性抗原;(2) 改变其抗原靶点对癌细胞的功能;(3) 促进肿瘤细胞的调理作用,导致通过DC上的Fcγ受体摄取抗原,并增强DC的呈递作用;(4) 激活补体级联;(5) 通过ADCC,导致巨噬细胞和NK细胞活化;(6) 通过ADCP发挥作用;(7) 产生具有细胞毒性免疫应答的IFN-γ和IL-12;(8) 通过颗粒酶B和TRAIL杀死肿瘤细胞。
在促肿瘤方面,B细胞可以通过IL-10的产生激活补体,从而诱导促肿瘤活性。促进癌症生长和进展的机制之一是癌症中免疫复合物的生成,免疫复合物可由抗肿瘤抗体生成。此外,巨噬细胞也可以被激活,并通过促炎介质与先前由B细胞生成的免疫复合物结合,促进促肿瘤活性。
关于细胞因子的产生,B细胞衍生的免疫抑制细胞因子可以抑制CD8+CTL和NK细胞功能。这些细胞因子包括:IL-10、TGF-β、IL-35、IL-21和TNF-β。此外,Breg细胞还能够产生腺苷,参与抑制T细胞活化。在最近的研究中,较高水平的Breg细胞表明,尿路上皮性膀胱癌和胃癌患者预后不良。
CD4+T细胞
Th细胞作为免疫反应的中央协调器,在细胞免疫反应的放大和调节中起着至关重要的作用。关于肿瘤,Th细胞具有多方面的作用:(1)通过分泌细胞因子,如IFN-γ和TNF-α,帮助B、NK细胞和CD8+CTL;(2)支持体液和细胞毒性反应;以及(3)直接抗肿瘤活性。由于这些特点,它们在发展和维持有效的抗肿瘤免疫、调节针对癌症的适应性免疫反应以及作为肿瘤免疫微环境中的关键调节因子方面的基本作用毋庸置疑。此外,它们也是免疫治疗的靶点,重点在于它们激活CD8+CTL反应的能力。
在促肿瘤方面,CD4+T细胞可能受TME的影响,产生支持肿瘤生存的促肿瘤功能的细胞因子。它们可能与其他类型的细胞联合作用,如MDSCs、TAMs。此外,由于其可塑性可以转化为Treg,Th1-Treg转化是小鼠和人类肺癌的特征。
Th2细胞主要与促肿瘤活性有关。它们通过增强血管生成、抑制细胞介导免疫杀死肿瘤细胞发挥作用。Th2介导的免疫中有一些关键因素可以发挥促肿瘤作用,例如嗜酸性粒细胞(IL-10抑制CTL对肿瘤细胞的溶解)、IL-13(NKT细胞衍生的IL-13抑制CTL激活);2型CD8+T细胞(分泌IL-10的Tc2细胞)、B细胞(通过IL-10分泌和免疫复合物的形成抑制CTL介导的肿瘤清除)。
调节性T细胞(Treg)是另一种Th亚群,其特点是在同种状态和炎症中都具有免疫抑制活性和耐受功能。由于本质上被认为是免疫抑制性的,它们本身并不像传统T细胞那样具有抗肿瘤活性。它们被认为是TME的支持,因为其可以通过IL-10和TGF-β的产生抑制TME中的抗肿瘤免疫效应器反应。
CD8+T细胞
CD8+T细胞是抗肿瘤免疫反应的主要效应细胞,通过MHC-I特异性识别APC呈递的抗原肽后,原始CD8+T细胞被激活,然后分化为细胞毒性效应T细胞。它们通过细胞毒性作用执行效应器功能,导致靶细胞死亡。与NK细胞类似,CD8+T细胞可以顺序结合和攻击多个靶细胞。因此,它们杀死肿瘤细胞的能力使它们在抗肿瘤免疫中起着关键作用。
在促肿瘤方面,CD8+T细胞有多个亚群(Tc1、Tc2、Tc9、Tc17、Tc22),但并非所有亚群都具有细胞毒性功能。Tc17细胞(以IL-17A、IL-17F、IL-21、IL-22产生和低水平颗粒酶B为特征)在不同的癌症中表现出双重作用,在食管鳞癌患者表现为抗肿瘤,而在HNSCC患者中表现为促肿瘤活性。此外,低Tc1/Tc2比率与涎腺肿瘤患者的不良预后相关。Tc22增加IL-22与促肿瘤活性呈正相关,因为它能够诱导移植相关SSC患者的肿瘤生长。
TME影响和调节的另一个机制是“CD8+T细胞耗竭”。这一过程导致效应器功能逐渐丧失,从而产生缺陷激活的肿瘤特异性T细胞。这种效应器功能的缺失涉及TNF-α、IFN-γ的缺失[519]和免疫检查点分子的高水平表达,。因此,由于存在免疫耐受和免疫抑制机制,肿瘤特异性耗竭的T细胞无法在晚期控制肿瘤进展。
小结
目前,众所周知,免疫系统能够通过其抗肿瘤免疫杀死肿瘤和转化细胞。然而,通过一种称为“癌症免疫编辑”的过程,这种能力可能会受到损害,导致肿瘤细胞可以逃避免疫监视,从而触发肿瘤生长。在这个过程中,为了生存,肿瘤创造了免疫抑制性的微环境,使本来具有抗肿瘤作用的免疫细胞可以转化为功能障碍、旁观者甚至促肿瘤细胞
在这种情况下,TME和免疫细胞以双向方式影响彼此的命运。因此,TME已成为癌症生物学中最重要的研究领域之一。更好地理解免疫逃避过程以及免疫细胞与TME之间的关系,可能有助于我们开发药物控制免疫细胞,终结肿瘤的免疫逃避。
参考文献:
1.Heterogeneous Myeloid Cells in Tumors. Cancers(Basel). 2021 Aug; 13(15): 3772.
2. Dual Effect of Immune Cells within TumourMicroenvironment: Pro- and Anti-Tumour Effects and Their Triggers. Cancers(Basel). 2022 Apr; 14(7): 1681.































