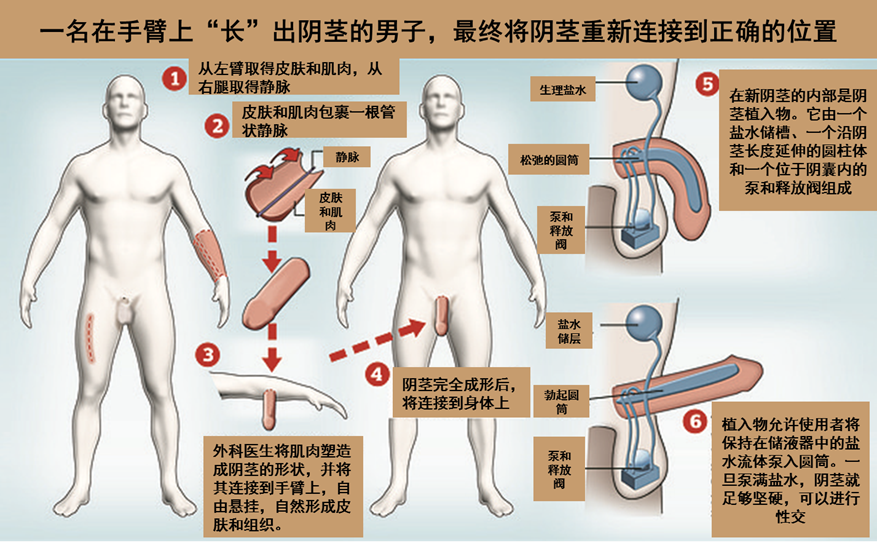
蝙蝠近几年因成为致命病毒的宿主而声名狼藉。蝙蝠除了携带曾在人类中反复爆发的 MERS 祖先版本外,还与导致 2003 年严重急性呼吸系统综合症爆发的病毒以及新型冠状病毒大流行的病毒非常接近。它们是埃博拉病毒的疑似宿主,也是亨德拉病毒、尼帕病毒和马尔堡病毒的天然宿主——所有这些病毒都可能对人类致命。

为什么蝙蝠能和这么多病毒共生?许多研究人员怀疑冠状病毒SARS-CoV-2是直接或通过中间宿主从蝙蝠传播到人体内的。近日,为了制造大量蝙蝠组织来研究为什么蝙蝠对病毒如此友好,有研究小组已经将成年蝙蝠细胞转化为多功能干细胞,这些干细胞可以被诱导形成多种组织,容纳大量内源性病毒序列,这些结果表明,蝙蝠已经进化出能够耐受大量病毒序列的机制。该研究题为“Bat pluripotent stem cells reveal unusual entanglement between host and viruses”,发表在Cell杂志。

蝙蝠具有飞行能力、使用喉部回声定位和耐受病毒的能力,这些特点使它们在哺乳动物中变得与众不同。然而,目前还没有可靠的细胞模型来研究蝙蝠生物学或它们对病毒感染的反应。研究人员从两种蝙蝠中创建了诱导多能干细胞 (iPSC):野生大马蹄蝠 ( Rhinolophus ferrumequinum ) 和大鼠耳蝠 ( Myotis myotis))。来自两种蝙蝠物种的 iPSC 显示出相似的特征,并且具有类似于被病毒攻击的细胞的基因表达谱。它们还具有大量内源性病毒序列,尤其是逆转录病毒。这些结果表明,蝙蝠已经进化出能够耐受大量病毒序列的机制,并且与病毒的关系可能比之前认为的更为复杂。
研究人员通过不断改进重编程方法研究出了诱导蝙蝠多能干细胞的最佳策略。由蝙蝠诱导的多能干细胞 (iPSC) 集落显得紧密且均匀,这些细胞充满了其他哺乳动物多能干细胞中没有的微小囊泡。除此之外,这些细胞表达多能性因子 Oct4并且增殖率与人类多能性细胞类似。
重编程方法对蝙蝠染色质和表观遗传结构的影响
研究人员接下来使用转座酶组合染色质测序分析 (ATAC-seq) 进行的全球表观遗传景观调查结果显示,当蝙蝠成纤维细胞转变为多能状态时,染色质配置发生了显着变化。有趣的是,虽然人类和蝙蝠的二价基因存在重叠,但也蝙蝠或人类也有独自的特异性基因。总的来说,研究结果表明蝙蝠多能干细胞在转录和表观遗传方面都被重新编程。
由于多能干细胞通常会在注射部位形成特定的肿瘤(畸胎瘤),研究人员接下来将R. ferrumequinum BiPS 细胞注射到免疫功能低下的小鼠体内。蝙蝠多能干细胞最终在四到五个月后形成了类似的肿瘤,由具有上皮、神经和间质特征的未成熟组织组成。
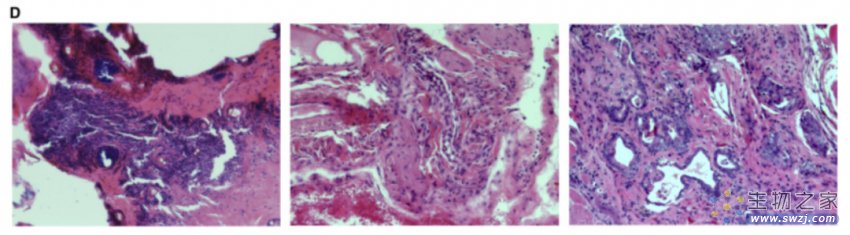
这些分化研究、说明了多能蝙蝠干细胞研究重要发育事件的潜力,并作为研究蝙蝠特殊生理适应性的强大模型,包括它们减少的癌症表型。最后,为了探究这种方法是否广泛适用于蝙蝠,研究人员从野生成年蝙蝠的 3 毫米尾巴活检组织中创建了原代鼠耳蝠成纤维细胞。这些细胞表现出幼稚和致敏多能性标记物的共表达并在大多数细胞中分化为三个胚层,这表明此研究方法适用于蝙蝠最深的基础差异。
转录组学差异
研究人员收集了来自不同发育系统哺乳动物物种的多能干细胞的转录组图谱,以将它们与大马蹄蝠(Rhinolophus ferrumequinum)的数据进行比较,然后确定了对蝙蝠特异性基因表达谱贡献最大的基因特征。研究人员发现,蝙蝠干细胞执行的程序在其他哺乳动物细胞中仅在病毒感染后才被激活。一些独特的蝙蝠特征可能是病毒序列的存在触发抗病毒细胞程序表达的结果,并且大多数编码前沿基因没有处于正向压力中。
蝙蝠干细胞中的内源性病毒
在整个进化过程中,蝙蝠已将多种病毒序列整合到它们的基因组中。研究人员假设与其他哺乳动物相比,蝙蝠多能干细胞会显示出一组特别丰富的表达内源性病毒序列和抗原。作者首先研究了蝙蝠基因组中丰富多样的内源性逆转录病毒,结果发现,表达的内源性逆转录病毒附近的染色质在重编程过程中以表观遗传方式打开,即重编程过程是导致蝙蝠干细胞中揭示多种内源性逆转录病毒 (ERV) 序列的原因。蝙蝠细胞能够产生 ERV 抗原,并且在某些情况下,与其他哺乳动物相比,蝙蝠细胞可能以不同寻常的规模产生活跃的内源性病毒样组装。
总结
蝙蝠在飞行、使用回声定位并对病毒具有奇特的亲和力时,在哺乳动物中进化出不同寻常的生活方式。一种可能性是蝙蝠通过进化其先天免疫的变化而进化出对病毒的耐受性,类似于哺乳动物免疫反应的病毒逃避机制。另一种可能性是,蝙蝠进化出了支持病毒复制和持久性的细胞程序机制,类似于病毒操纵宿主细胞的方式。
蝙蝠多能干细胞中存在潜在重要的内源性和外源性病毒产物,而不会严重损害它们的增殖和生长能力,这超出了其他多能干细胞对病毒的反应。来自美国国家过敏和传染病研究所的病毒学家 Vincent Munster说:我们已经讨论如何利用这些多能干细胞,这是一项了不起的研究。如果这篇论文中的工作可以在不同蝙蝠物种的其他群体中复制,影响将是巨大的。
来源:
https://www.science.org/content/article/how-do-bats-live-so-many-viruses-new-bat-stem-cells-hint-answer
https://www.cell.com/cell/fulltext/S0092-8674(23)00041-7