本周,心脏发育学研究迎来了重大进展。
来自德国慕尼黑大学的Alessandra Moretti教授与同事先后在Nature Biotechnology和Nature Communication两本杂志发表论文,用单细胞测序技术揭开了心脏发育过程中的新型分子机制,为研究先天性心脏病和用干细胞治疗心肌损伤提供了治疗的可能性。
Moretti教授和她的团队是世界上第一批成功创建包含心肌细胞(心肌细胞)和心壁外层细胞(心外膜)的类器官的研究人员。Moretti教授的代表性研究成果有:
· 2010年,描述了如何使用干细胞来创建人类心肌组织
· 2015年,发现如何使用干细胞生成自组织的外心包体(epicardioids),并用外心包体模拟心脏疾病的发展
· 2018年,使用单细胞转录组学和谱系追踪来探索干细胞生成心脏组织的分子机制。这项研究发现,心脏细胞的分化是一个高度分化的过程,其中许多分子途径在不同细胞类型中发挥作用
· 2021年,使用已经大火的基因编辑和干细胞技术来纠正心脏病的遗传突变
可以说,Alessandra Moretti教授的研究成果是一部紧贴当代生物技术发展历程的编年史。在刚刚发表在Nature Biotechnology论文中,他们解决了此前多能干细胞(iPSC)诱导心脏类器官无法自发形成心外膜区域的问题,并用心外膜体的时间序列单细胞基因组学和谱系追踪揭示了人类心心外膜谱系的发育轨迹、与其他心脏细胞类型的功能交互作用。

首先,为了建立含有心外膜的心脏类器官,该团队首先调节了iPSC细胞球体的BMP4和bFGF通路。然后是本方法的重点——加入视黄酸(RA)。RA是一种维生素A代谢物,在自然过程下可以促进心外膜发育。RA的加入逐步诱导中前部原始条带、心脏中胚层和心血管衍生物的分化;去除分化刺激后,将球体嵌入凝胶中进行3D培养,这种凝胶高度模拟了体内心脏的胞外基质。
结果表明,RA处理的球体比noRA(无RA)球体更早展现出完整的心脏功能:开始自发跳动,拥有紧实的心肌细胞核心和一个厚厚的包裹层,而包裹层中含有大量表达了心外膜标记物WT1、TBX18、BNC1、ALDH1A2和TCF21的细胞。
Alessandra Moretti教授并不满足于此,他们发现球体中内皮细胞占比不多,于是又在球体培养基中添加了血管生成因子血管内皮生长因子(VEGF),获得了明显的类血管结构。至此,他们得到了可以在不同iPSC细胞系中都重复诱导出完整心脏器官体的方法。
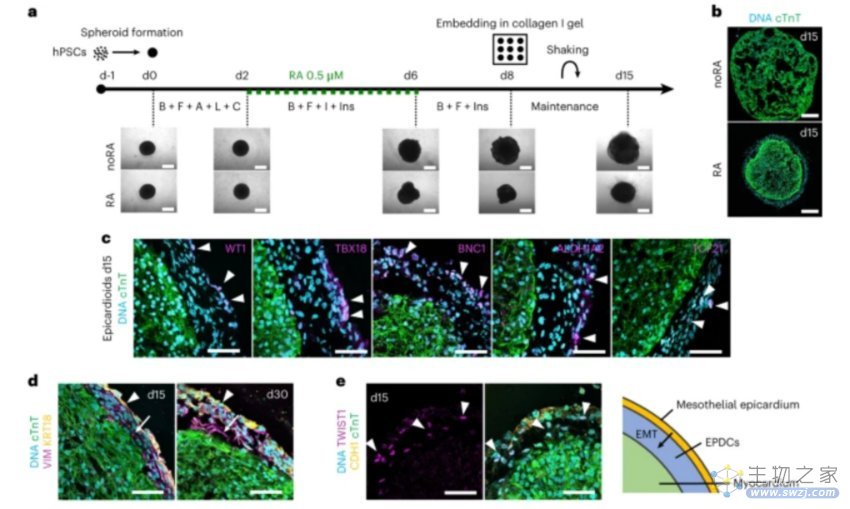
图1. 在iPSC球体中诱导心外膜生成[2]
随后的单细胞测序实验也表明,体外诱导出的器官体中,最丰富的细胞是室性心肌细胞(vCMs),而且这类vCM在培养时间延长时也在逐渐成熟。器官体中还发现了成熟的血管平滑肌细胞(SMCs)。最重要的是,通过与人类胎儿心外膜的测序数据集进行比较,他们确定了三个表达心外膜标记的聚类——间皮心外膜、心外膜衍生的间充质和增殖细胞。
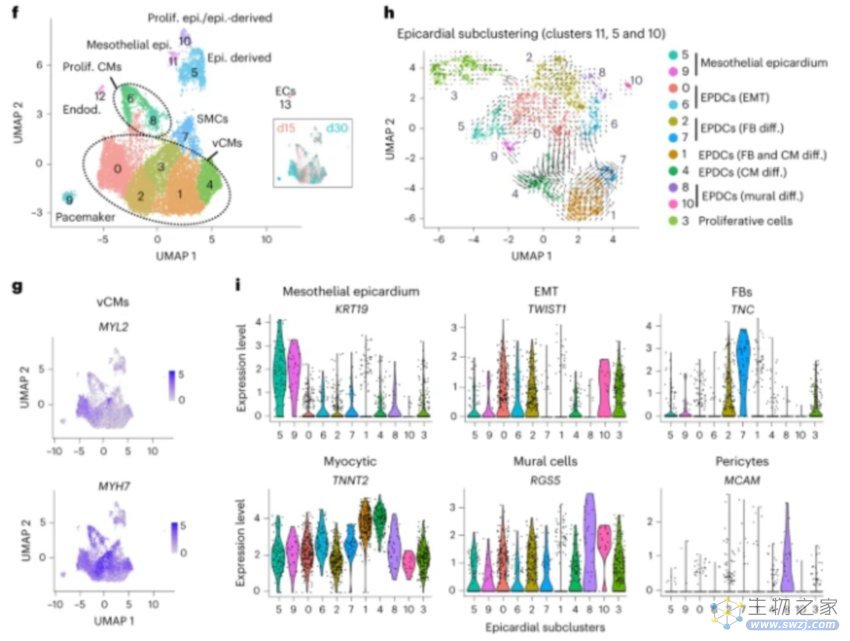
图2. 心脏器官体的单细胞测序结果[2]
在证明了器官体模型的严谨性后,该团队开始研究不同心脏细胞之间的“互动”。对单细胞测序数据的进一步分析表面,心外膜与其他细胞类型之间存在大量的相互作用,包括但不限于:刺激小鼠中的心肌细胞增殖,促进冠状血管生成,心肌细胞、内皮细胞和成纤维细胞之间的配体-受体相互作用等等,这其中就包括心外膜IGF2和心肌细胞中IGF1R这一对配体-受体。
他们重点研究了这一对配体-受体的相互作用,使用小分子IGF1R抑制剂linsitinib处理了器官体。Linsitinib处理显著降低了心肌细胞的分裂,而在使用IGF2处理noRA 器官体(缺乏心外膜)时,结果则相反。IGF2的处理剂量依赖性地增加了心肌细胞密度,这表明在没有外心包的情况下,IGF2足以诱导心肌紧缩。
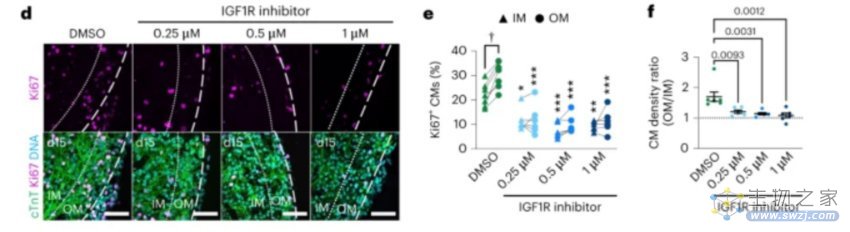
图3. 心外膜IGF2和心肌细胞中IGF1R相互作用以促进器官体中的心肌紧缩[2]
那么,这些心外膜细胞是哪儿来的呢?他们的“祖先”是谁?
团队用scRNA-seq 和 scATAC-seq,结合计算生物学方法,在时间轴上跟踪细胞轨迹,沿着这些轨迹,他们检测到早期心肌中胚层的诱导,然后出现了表达FHF祖细胞标记物的细胞(TBX5、NKX2.5和SFRP5)。上皮心膜细胞及其派生物在第10天首次出现,并在第15天扩展 ,这些细胞之前是潜在的“pre-JCF”前体细胞,而这类“pre-JCF”前体细胞正是后来的心外膜细胞主要来源。有趣的是,“pre-JCF”前体细胞在人类中具有“双能“,即能产生心肌和心外膜两类细胞。
而在该团队本周发表在Nature Communication的另一篇论文中,他们则重点讨论了视黄酸RA如何影响早期中胚层形成期间的人类心血管前体细胞的分化。论文表明,通过调节早期中胚层细胞中的RA信号,可以分化出包括JCF前体在内的心血管前体细胞。

为了进一步探索这些JCF细胞的潜力,他们将体外培养的早期胚胎和小鼠数据进行比较,发现TNC、AHNAK和ITGA8这几个差异基因,与其他关键JCF标记物共同表达。随后他们进一步验证了在人类心脏发生过程中,存在一个能够生成心肌细胞和心外膜细胞的双能JCF前体池,并可以使用ITGA8作为膜标记物富集。
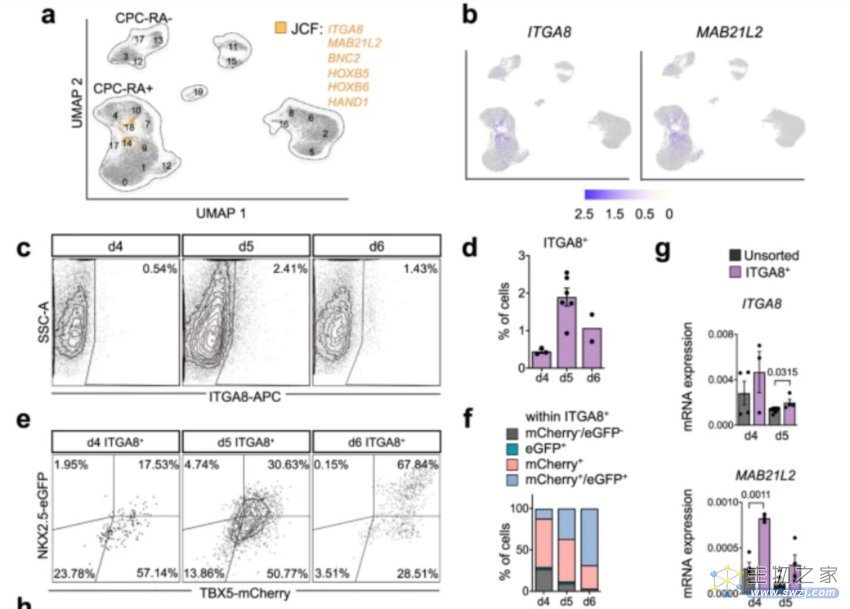
图4. ITGA8+的pre-JCF前体细胞被发现[1]
至此,心外细胞的来源被大致摸清:中胚层 – FHF – pre-JCF (ITGA8) – 心肌细胞和心外膜细胞。
或者我们可以毫不夸张地说,这个带有心外膜的心脏类器官对于心脏研究领域的意义,就像能够产生滋养层的体外胚胎一样对干细胞研究的意义一样重大,它使我们能够解决与心外膜异质性和命运潜能相关的很多悬而未决的问题。
从广义上来说,心外膜团使细胞内和细胞间相互作用的动态剖析成为了可能,为建模复杂的心脏疾病,包括先天性心脏病提供了优势。从心外膜团中获得的见解也可以带来新的策略,以替换心肌梗死期间丢失的心肌细胞,而这无疑是现代医学面临的最大挑战之一。因此,心外膜团为解决发育生物学以及心血管医学和药物发现中的基本问题提供了独特的平台。
参考文献:
1. Zawada, D., Kornherr, J., Meier, A.B. et al. Retinoic acid signaling modulation guides in vitro specification of human heart field-specific progenitor pools. Nat Commun 14, 1722 (2023). https://doi.org/10.1038/s41467-023-36764-x
2. Meier, A.B., Zawada, D., De Angelis, M.T. et al. Epicardioid single-cell genomics uncovers principles of human epicardium biology in heart development and disease. Nat Biotechnol (2023). https://doi.org/10.1038/s41587-023-01718-7































