人的心脏大约在受孕后的三周开始形成。不过,在这个属于心脏发育的早期阶段,很多女性并未意识到自己已经怀孕,这也是我们对心脏如何形成的许多细节知之甚少的原因之一。同时,由于人类心脏微环境的复杂性,很多动物研究的结果仍不能完全转移到人类身上。
人类胚胎组织的不可及性,使得人们对人心外膜发育和功能的理解留有很大的空白。关于人类心外膜前体个体发育和心外膜细胞功能异质性的许多问题仍未解决,进一步限制了它们在再生医学中的全部潜力。
心脏类器官一直是干细胞领域的研究热点。近日,慕尼黑工业大学 (TUM) 的研究团队成功地诱导干细胞模拟出人类心脏的发育!他们构建了一种“迷你心脏”类器官。这一研究结果,将促进我们更好地了解心脏的最早发育阶段,从而找到疾病的治疗靶点及方法。
该文章题为“Epicardioid single-cell genomics uncovers principles of human epicardium biology in heart development and disease”,发表在Nature Biotechnology杂志。

一、研究背景
心外膜是覆盖心脏外表面的间皮细胞层。长期以来,心外膜被认为是心包腔和心肌之间的简单屏障,而现在则被认为在心脏发育和修复中具有关键功能。多能干细胞 (PSC) 衍生的心脏类器官已成为人类发育和疾病的强大体外模型,但尚未证明其能够自发形成真正的心外膜腔室。
本篇研究中,研究人员成功构建了能够显示功能性心室心肌和心外膜自组织的心脏类器官,称之为心外膜类器官。
心外膜类器官中时程单细胞基因组学与谱系追踪相结合揭示了人类心外膜起源和生物学的原理,包括心外膜谱系的发育轨迹和与其他心脏细胞类型的功能交叉作用。此外,该研究还表明心外膜类器官代表了一种先进的系统来模拟心脏病的多细胞机制。
二、研究方法
1. 三维心脏感应
在第1天,将 30,000-40,000个hPSC接种到聚 HEMA 涂层U 形 96 孔板中,并置于含有2 µM thiazovivin的essential 8培养基中。通过将 247.36 毫升 DMEM/F-12 与 GlutaMAX、237.36毫升IMDM、5毫升化学成分确定的脂质浓缩物、10 毫升含有10%牛血清白蛋白(BSA)、250 µl转铁蛋白和20 µl α-硫代甘油的 IMDM混合。
在第 0 天,将基本培养基 8 替换为添加了 10 ng ml–1 BMP4、50 ng ml–1激活素 A、30 ng ml–1的基础培养基bFGF、5 µM LY-29004和 1.5 µM CHIR-99021。
第 2 天,将培养基更换为添加了 10 µg ml–1胰岛素、10 ng ml–1 BMP4、8 ng ml–1 bFGF、5 µM IWP2。该培养基每 24 小时更新一次,直到第 6 天,此时将培养基更换为补充有10 µg ml–1胰岛素、10 ng ml–1 BMP4 和 8 ng ml–1 bFGF的基础培养基。
该培养基在第 7 天 24 小时后更新。在第 8 天,球体被包埋在由 2.17 mg ml–1胶原蛋白I、20% 蒸馏水、5% 10× DPBS和 8.3 mM NaOH添加到由 DMEM/F-12 和 20% 胎牛血清组成的胶原蛋白I培养基中。
2. 细胞处理
在细胞-细胞相互作用实验中,心外膜样细胞在维持培养基中用0.25 µM、0.5 µM 或 1 µM linsitinib或 200 µg ml–1或 500 µg ml–1 NRP2 阻断抗体处理数天11、12、13 和 14。在第 11、12 天,在维持培养基中用 25 ng ml–1、50 ng mL–1或 100 ng ml–1重组人 IGF2处理分化的球状体, DMSO 用作载体对照。
为了诱导肥大,第 30 天的心外膜在维持培养基中用 25 nM 或 50 nM ET1处理 6 天,并且每天更换培养基。然后将心外膜类器官与 papain酶解离以重新接种,在 37°C 下与 TrypLE Express解离 15 分钟以提取 RNA 或固定。
3. 谱系追踪
1)生成AAVS1-CAG-FRT 侧翼 STOP-mKate2-HA 报告线
2)生成慢病毒CDH1和MAB21L2启动子报告基因以及 JCF 和间皮心外膜的谱系追踪
4. 免疫荧光分析
5. 制备用于单细胞测序的细胞
6. 多组学分析
1)整合 scRNA-seq 和 scATAC-seq 数据
2)聚类、DEG 和可视化
3)细胞命运轨迹的推断
4)GRN 推理
5)基因模块构建
6)GRN的可视化
7)特异性分支的TF活性
8)心外膜细胞亚群
7. 振动切片机制备活切片
8. 光学动作电位测量
9. 钙成像
10. 实时定量PCR
11. 测量心肌细胞尺寸
三、研究结果
研究人员为了建立包含心外膜室的心脏类器官,在 96 孔 U 型底板中生成了 hPSC 球体,使用Wnt, activin A, bone morphogenic protein 4 (BMP4) and basic fibroblast growth factor (bFGF)信号通路调节分化的方案进行诱导。
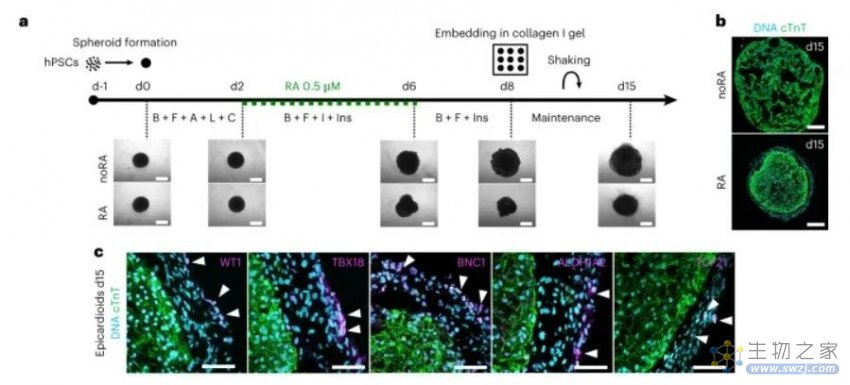
自组织心室心肌和心外膜的hPSC 衍生心外膜类器官的生成
由此产生的类器官直径约为半毫米。虽然它们不泵血,但它们可以受到电刺激,并且能够像人类心室一样收缩。Moretti教授和她的团队是世界上第一批成功创建含有心肌细胞和心壁外层细胞(心外膜)的类器官的研究人员。在心脏类器官的年轻历史中——第一个在 2021 年被描述——研究人员只用心肌细胞和来自心脏壁内层(心内膜)的细胞创造类器官。
“要了解心脏是如何形成的,心外膜细胞是决定性的,”该研究的第一作者 Anna Meier 博士说,“心脏中的其他细胞类型,例如连接组织和血管的细胞,都是由这些细胞形成的。心外膜在形成心腔方面也起着非常重要的作用。” 该团队恰当地将新的类器官命名为“epicardioids”。
除了生产类器官的方法外,该团队还报告了第一个新发现:通过对单个细胞的分析,他们确定了最近才在小鼠身上发现的一种前体细胞是在类器官发育的第七天左右形成的,而心外膜由这些细胞形成。
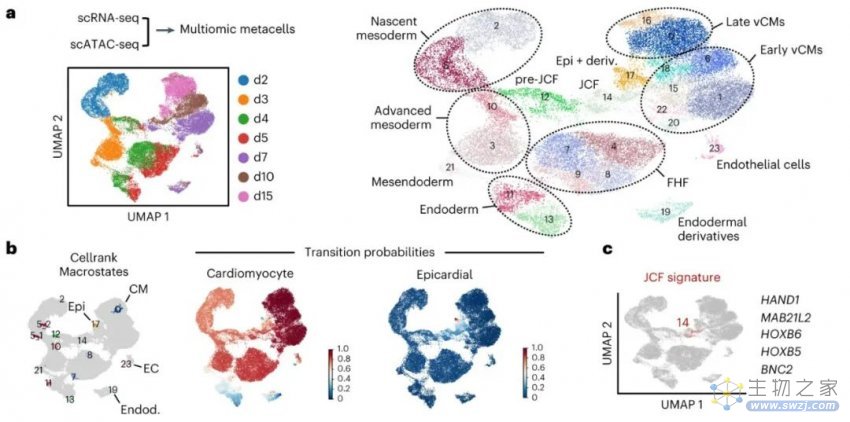
心外膜类器官由第一心区和近心区祖细胞的早期分离形成
这些见解可能为我们以后的研究提供线索,说明“为什么胎儿心脏可以自我修复,而成年人的心脏几乎没有这种能力”。该研究结果或有助于找到治疗心脏病和其他疾病的新方法。
该团队还表明,类器官可用于调查个体患者的疾病。研究人员使用来自一名患有努南综合征的患者的多能干细胞,在培养皿中生成了模拟该病症特征的类器官。在接下来的几个月里,该团队计划使用类似的个性化类器官来研究其他先天性心脏缺陷。
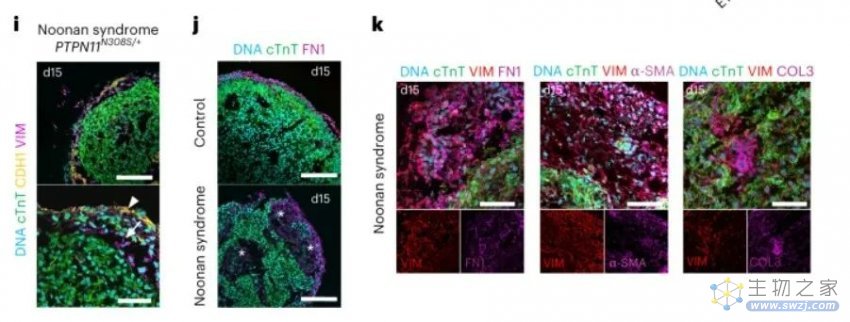
来自 Noonan 综合征患者的第 15 天 hiPSC 的心外膜样细胞中的cTnT、CDH1 和波形蛋白的免疫染色
四、总结
这篇文章中,研究人员生成了自组织的人多能干细胞衍生的心外膜类器官,这些心外膜类器官显示出左心室壁典型的心外膜和心肌的视黄酸依赖性形态、分子和功能模式。
通过结合谱系追踪、单细胞转录组学和染色质可及性分析,研究人员描述了心外膜中不同细胞谱系的规范和分化过程,并在转录和形态学水平上与人类胎儿发育进行了比较。然后使用心外膜来研究心脏细胞类型之间的功能性相互作用,获得关于 IGF2/IGF1R 和 NRP2 信号在人类心脏发生中的作用的新见解。
最后该研究表明心外膜模仿先天性或应激诱导的肥大和纤维化重塑的多细胞发病机制。由此可见,心外膜类器官在心脏发育、疾病和再生过程中提供了心外膜活动的场所。
研究人员已经为创建心脏类器官的过程注册了一项国际专利。Epicardioid 模型是 TUM 的几个类器官项目之一。在类器官系统中心,来自不同部门和主席的工作组将进行协作。他们将通过最先进的成像和细胞分析对胰腺、大脑和心脏类器官进行跨学科研究,以研究器官的形成、癌症和神经退行性疾病,并通过人体 3D 系统取得医学进展。由于有可能在类器官中模拟心脏病,未来可以直接在类器官上测试药物。研究人员说:“可以想象,这样的测试可以减少开发药物时对动物实验的需求。”
来源:https://www.nature.com/articles/s41587-023-01718-7#Abs1































