近期,部分新冠病毒感染者在就诊过程中出现“白肺”现象。什么是“白肺”?白肺是肺部影像学表现的一个口语化描述,指患者在进行胸部X线片检查或胸部CT检查时,肺部组织呈现大片状白色病变的表现。“白肺”表现多见于重症肺炎。
缺乏巨噬细胞的多样性是肺部受损严重的重要原因
为什么有些人受到新冠的严重影响,而许多人却几乎没有受到它的影响?年龄和其他健康状况增加了患重病的风险,但一项新的研究表明,那些逃离最严重症状的人来自可以获益于“巨噬细胞的正确平衡”[1]。
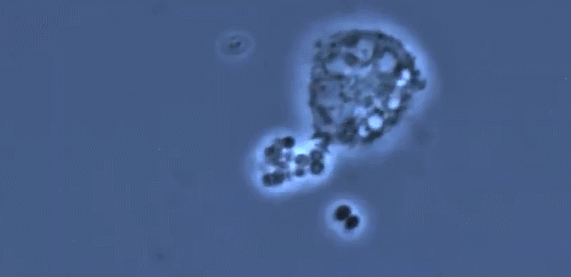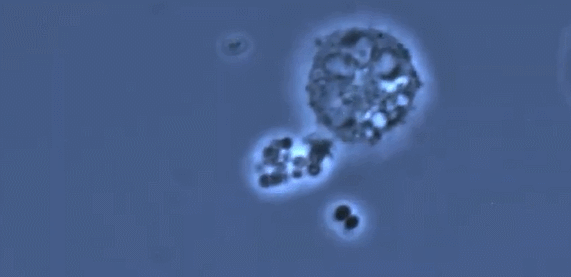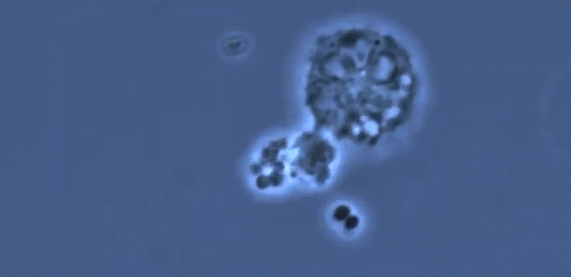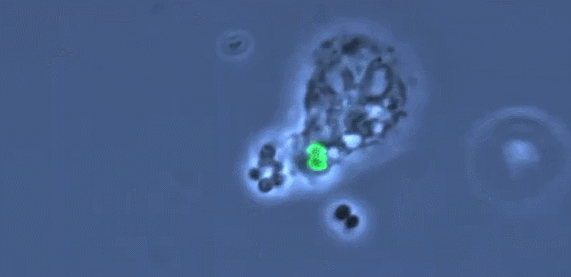
受新冠病毒攻击影响更严重的肺部特征是缺乏巨噬细胞的多样性,它主要由一种名为M1的促炎巨噬细胞控制,它对病毒和细菌做出反应,驱动了过度炎症反应的发生,导致重症疾病状态。而在肺部状态良好的小鼠当中,可以看到更多的用于伤口修复的M2调节性巨噬细胞。一个具有多样化的巨噬细胞群可以有效调节驱动抗病毒的信号,又可以在适当时候关闭它。免疫系统就可以迅速清除病毒,还可以保护组织。(简而言之,“人体免疫系统能够有效保护肺部健康”这一结论,是建立在活性M1、M2比例适当的前提之下的,如果M1过度活跃而M2缺位,将会导致重症状态)
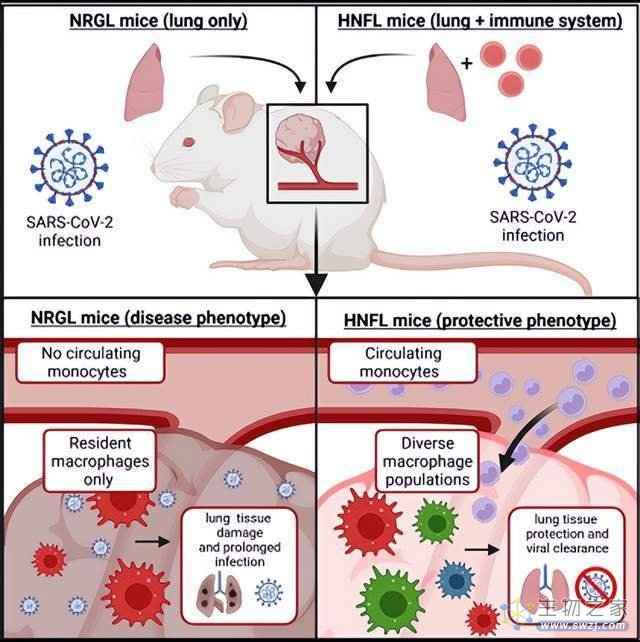
(图片来自文献1,进行人类肺移植和免疫系统人源化和的小鼠试验揭示巨噬细胞多样性对肺组织的保护作用)
波士顿大学国家新兴传染病实验室微生物学系副教授Florian Douam介绍,免疫系统的巨噬细胞是人体重要的安全卫士。它可以修复伤口,一旦出现损伤,它可以迅速集结帮助自我修复;它可以攻击入侵者,吞噬消化任何不属于人体自身的东西,如死亡细胞和微生物,维持人体健康。然而,这种攻击机制又是重症新冠肺炎的因素之一。越来越多的证据表明,多数新冠重症和死亡源于免疫系统过度反应,狂暴的巨噬细胞不仅攻击病毒,还攻击人体导致心脏、肺部等组织损伤。
巨噬细胞的M1和M2
巨噬细胞可分化为具有不同生物学特征的M1型和M2型两类。
M1型巨噬细胞参与急性促炎反应,清除入侵病原体和肿瘤细胞。M1型巨噬细胞主要发挥针对病原微生物的炎症反应和发挥宿主的免疫防御功能,也会造成机体损伤。

M2型巨噬细胞参与杀伤细胞外病原体、碎片清除、组织修复和伤口愈合。M2型巨噬细胞表现出很强的抗炎活性,对于修复和重塑炎症后期由病原微生物造成的组织损伤以及重建组织稳态中作用重大。
巨噬细胞具有可塑性,不同的刺激下能使尚未分型的成熟巨噬细胞发生分型极化,而且已分化的M1型和M2型巨噬细胞之间可以相互转化。
间充质干细胞的免疫调节机制
间充质干细胞疗法为治疗多种炎症和自身免疫性疾病提供了很多令人信服的证据,具有潜在的抗炎和免疫调节作用。其治疗炎症可能的机制是间充质干细胞能够迁移到炎症部位,并调节各种免疫细胞群。
其中,对于巨噬细胞的调节作用表现为:它不仅抑制M1型巨噬细胞活性,还能诱导M1型巨噬细胞向M2型巨噬细胞极化,使M2型巨噬细胞功能进一步活化,抗炎因子生成增多,促炎因子生成减少,由组织促炎反应向抗炎反应调节,进而改善失控性炎症反应。
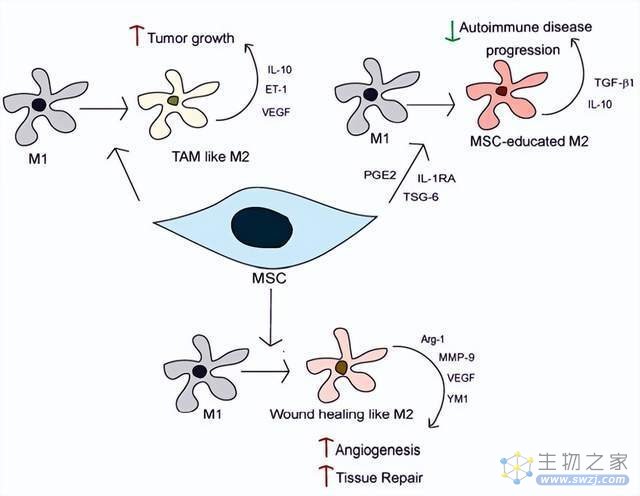
(图片来自文献2,间充质干细胞调节巨噬细胞极化与功能)
间充质干细胞改善重症新冠患者的肺损伤
发表《International immunopharmacology》杂志的一项研究[4]将间充质干细胞注入肺损伤小鼠模型中,发现巨噬细胞表面 CD86 表达和肺泡液中促炎因子水平均降低,表明间充质干细胞可抑制巨噬细胞向 M1 表型极化,并刺激其向 M2 表型极化,也证明了 MSC 是通过恢复 M1/M2 型巨噬细胞群之间的平衡而发挥作用的。
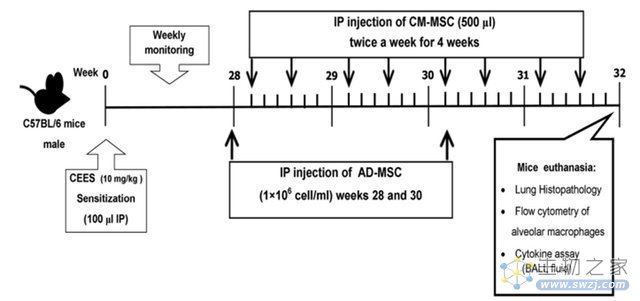
(图片来自文献3,间充质干细胞治疗肺损伤的机制研究方案)
2021年2月,王福生院士团队在Nature子刊《Signal Transduction and Targeted Therapy》上发表了一项随机、双盲、安慰剂对照II期临床试验的结果。该项试验表明,间充质干细胞加速了COVID-19重症患者肺实性病变的消退,改善了肺的综合储备能力,并证实了良好的耐受性和安全性,间充质干细胞治疗为COVID-19肺损伤患者提供了一种安全且潜在有效的治疗选择。这也是继I期临床研究之后,再次证明间充质干细胞在治疗新冠肺炎方面的突出价值。
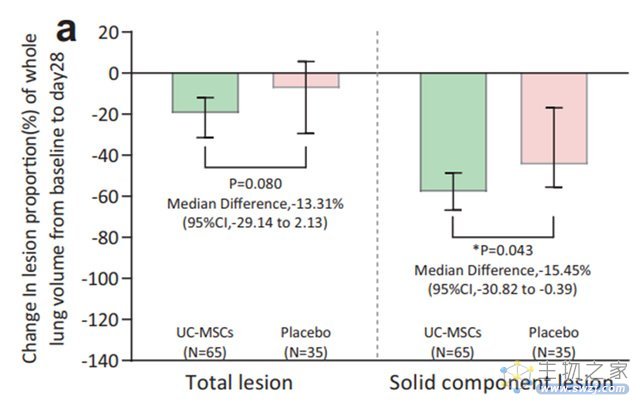
(图片来自文献4,间充质干细胞改善COVID-19重症患者的肺部病变)
间充质干细胞具有强大的调节炎症反应和免疫反应的作用。间充质干细胞就像免疫环境的一个调和剂,维持免疫平衡:当炎症反应过强时,它会抑制免疫反应; 当炎症反应减弱时,它会促进免疫反应。通过对免疫反应、炎症反应的调节作用,间充质干细胞可以在一些自身免疫性疾病和各种炎症性疾病,譬如移植物抗宿主病、系统性红斑狼疮、糖尿病、类风湿关节炎、创伤性系统性炎症等病症中发挥很好作用。
参考文献
[1]Kenney DJ, O'Connell AK, Turcinovic J, et al. Humanized mice reveal a macrophage-enriched gene signature defining human lung tissue protection during SARS-CoV-2 infection. Cell Rep. 2022 Apr 19;39(3):110714.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8977517/pdf/main.pdf
[2] Luz-Crawford P, Jorgensen C, Djouad F. Mesenchymal Stem Cells Direct the Immunological Fate of Macrophages. Results Probl Cell Differ. 2017;62:61-72.
https://www.sci-hub.se/10.1007/978-3-319-54090-0_4
[3] Sadeghi S, Mosaffa N, Hashemi SM, et al. The immunomodulatory effects of mesenchymal stem cells on long term pulmonary complications in an animal model exposed to a sulfur mustard analog. Int Immunopharmacol. 2020 Mar;80:105879. https://www.sci-hub.se/10.1016/j.intimp.2019.105879
[4] Shi L, Huang H, Lu X, et al. Effect of human umbilical cord-derived mesenchymal stem cells on lung damage in severe COVID-19 patients: a randomized, double-blind, placebo-controlled phase 2 trial. Signal Transduct Target Ther. 2021 Feb 10;6(1):58.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7873662/pdf/41392_2021_Article_488.pdf































