去年3月,国际顶尖学术期刊 Nature 发表了一篇关于“细菌注射器”的论文,论文第一作者为 Joseph Kreitz,看到这个与自己同名的人发表了自己一直在探索的方向的重磅论文,NanoSyrinx 公司的 CEO Joseph Healey 第一反应是“惊讶”。
Joseph Healey 表示,之所以感到惊讶,是因为从事“细菌注射器”相关研究的团队我们基本都认识,而这篇论文毫无征兆地出现,来自一个之前从未进行相关研究的团队。
正如 Joseph Healey 猜测的那样,这是一个由学生推动的研究项目,论文第一作者 Joseph Kreitz 是张锋实验室的研究生,张锋实验室此前从未关注过“细菌注射器”系统,Joseph Kreitz 在了解到这种具有蛋白质递送能力的奇特的注射器系统后,深入研究了相关文献,最终发表了这项受到广泛关注的研究论文。
在最初的惊讶和情绪波动后,Joseph Healey 想知道自己的公司所做的研究是否被抢先报道了,以及自己的知识产权还是否安全,然后,他开始产生一种成功的感觉,他表示,张锋实验室这篇论文很棒,数据也很惊人。而这篇论文对自己也很有帮助,因为提供了外部验证,说明了我们不只是在实验室中埋头开发“细菌注射器”的小配角。

Joseph Healey
几年前,Joseph Healey 在英国考文垂创立了这家名为NanoSyrinx的公司,旨在将“细菌注射器”转化为药物递送系统。该公司的投资者和合作公司都认为,张锋实验室的这项研究是一个巨大的支持。
在张锋实验室这篇论文发表大约十个月后,Joseph Healey 来参加了在旧金山举行的第42届摩根大通医疗健康年会(JPM大会),为NanoSyrinx公司寻求新一轮的融资,以扩大研发管线,进行体内安全性和有效性研究。
Joseph Healey 表示,基于“细菌注射器”的药物递送系统之前从未被使用过,公司已经做了一些安全性和有效性研究,接下来希望尽可能广泛地进行多剂量系统性给药。关于该系统的免疫原性和给药后的生物分布,仍然存在一些常见的问题。新一轮的融资能够帮助我们完善这些问题,并帮助我们更全面地了解这一系统。
细菌注射器系统——eCIS
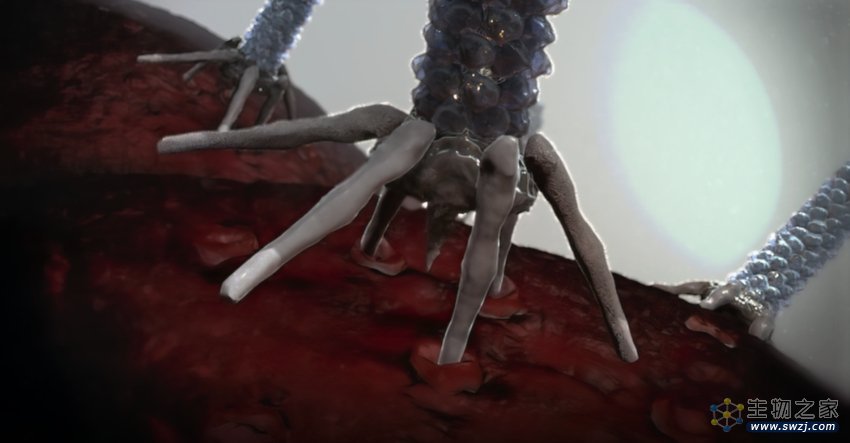
内共生细菌是一类特殊的细菌,它们可以寄生在宿主细胞的内部,并已然进化出复杂的传递系统使其分泌调节宿主细胞的生物因子。例如,细胞外可收缩注射系统(eCIS),这是一种类似于“注射器”的大分子复合物。eCIS通过驱动一个“针头”样结构穿透细胞膜,然后将携带的蛋白质有效载荷注入到真核细胞中。
eCIS广泛分布在细菌和古菌中,并已被证明具有多种天然功能,包括调节宿主细胞骨架、DNA切割,诱导变形运动和产生宿主毒性。此前有研究发现eCIS可以靶向小鼠细胞,这表明了eCIS具有作为蛋白质递送工具的潜力。
但是,eCIS的活性尚未在人类细胞中得到证实,如果想要将eCIS开发为靶向递送系统,就要先阐明eCIS识别靶细胞的机制。
张锋实验室的突破性研究
2023年3月29日,CRISPR基因编辑先驱张锋教授及其团队在 Natrue 期刊发表了题为:Programmable protein delivery with a bacterial contractile injection system 的研究论文。
张锋团队利用AlphaFold辅助蛋白质设计,改造了来自细菌的注射器系统,从而开发了一种新型蛋白质递送系统,能够将蛋白质有效递送到人类细胞中,这种新型蛋白质递送方式或将改变基因治疗、癌症治疗等前沿疗法格局,具有强大的应用前景。

在这项最新研究中,张锋团队首先选定了eCIS的一个亚型——Photorhabdus virulence cassette(PVC)。PVC由一个约20kb的操纵子组成,包含16个核心基因(pvc1-16),以及下游的有效载荷Pdp1和Pnf。PVC有效载荷蛋白的N端高度无序区域是其“包装结构域”,只要将其与想要递送的蛋白融合,就能将其加载到PVC复合体中。
值得注意的是,除了N端高度无序区域之外,Pvc13(尾纤维蛋白)和Pvc15(一种ATP酶)也是该递送系统成功的关键。其中,Pvc13可能参与了PVC复合体的靶标识别,并可用于操纵PVC复合体的靶标特异性。基于此,研究团队使用AlphaFold预测Pvc13的三维结构,当将其作为三聚体时,Pvc13的C端形成了一个预测的螺旋管结构和一个球状的尖端结合结构域。研究团队由此假设,改变Pvc13的这个尖端结合域的结构特征可能会导致PVC的靶向性发生可预测的变化。
为了验证这一点,研究团队将针对人类细胞的结合结构域(Ad5-knob和E01-DARPin)插入到Pvc13的C端结合域,并测试由此产生的PVC复合体是否可以靶向人类细胞。结果显示,改造后的PVC可以有效杀死A549细胞(携带毒性基因)或高效表达GFP(融合蛋白)。这些结果表明,Pvc13是PVC复合体的一个靶向性决定元件,该蛋白可以被修饰,从而靶向特定的细胞系。
进一步研究显示,改造后的PVC复合体还可以自由装载spCas9、锌指脱氨酶(ZFD)以及细胞毒素等不同的效应元件,前两者分别实现对靶细胞DNA的基因编辑和不依赖RNA的基因编辑,后者则可以靶向清除癌细胞、衰老细胞等有害细胞。
为了验证PVC递送系统在活体动物中的效果,研究团队再次使用AlphaFold引导Pvc13的工程化设计,并筛选到两种靶向小鼠细胞的PVC系统。研究团队还发现,PVC治疗没有产生任何显著的免疫细胞激活、炎症细胞因子产生、体重损失或细胞毒性,这表明PVC治疗在实验过程中没有产生免疫原性或毒性。此外,PVC治疗七天后就无法从小鼠大脑中检测到PVC相关蛋白,这表明PVC递送系统仅在大脑中短暂停留,不会持续太长时间。
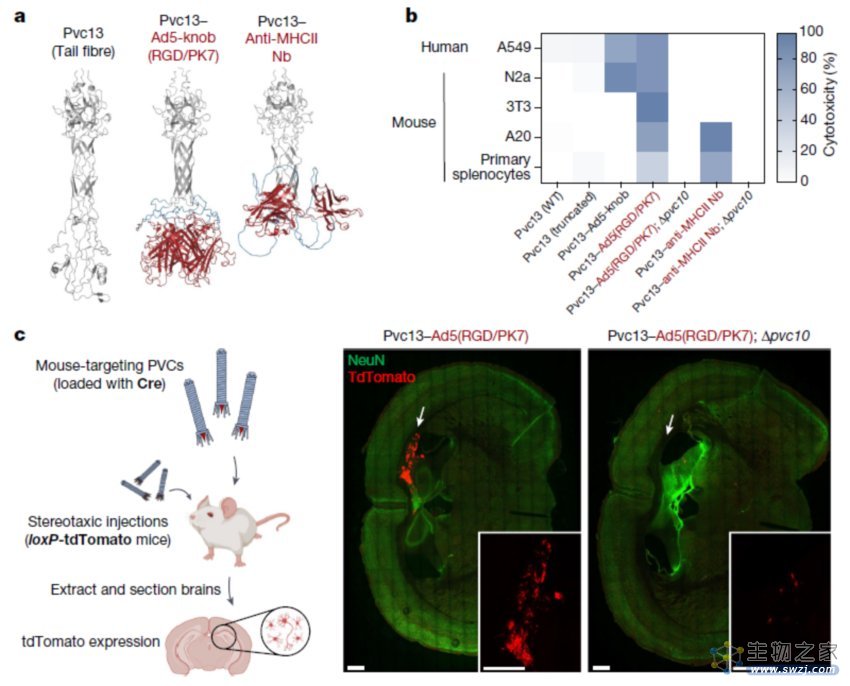
重编程的PVC系统在小鼠体内实现靶向递送
总的来说,这些结果表明,基于细菌注射器系统改造而来的PVC系统,经过优化后可以在细胞和体内靶向递送蛋白质,并在基因编辑、癌症治疗和临床靶向递送等领域展现出广阔的应用前景,未来可能成为许多生物疗法的关键递送工具。
关于NanoSyrinx
Joseph Healey 之所以认为张锋实验室的这些研究数据令人振奋但对自己的公司来说并非威胁,这是因为他认为自己才是那个开发了PVC系统的人。他在华威大学 Nicholas Waterfield 教授(他也是NanoSyrinx公司的联合创始人)实验室读博期间进行了这些研究,并在2018年发表的博士论文中提出了使用PVC系统进行真核细胞内靶向递送。

2020年9月,NanoSyrinx公司宣布完成了种子前融资,投资者包括默克风险投资部、BioCity和UKI2S。2021年,NanoSyrinx公司进一步完成了620万英镑的种子轮融资。自那时起,NanoSyrinx公司一直在努力掌握制造这种不同寻常的“细菌注射器”,但除了使用微生物发酵外,还没有针对制造这种纳米注射器递送系统的各个方面的成熟解决方案,更不用说在CMC级医疗用途上。
NanoSyrinx公司则使用合成生物学和分子生物学来操纵这一递送系统,以提高递送效率并减少潜在毒性。他们开发了生物测定方法来展示有效载荷的递送,并在过去几个月里,一直在为自己的研发管线和合作方(例如阿斯利康)进行超越概念验证之外的实验,以进入治疗模式。
张锋会在该领域创业吗?
基于发光杆菌(Photorhabdus)的“细菌注射器”,源自数百万年前的噬菌体,其最终整合到了细菌基因组中。Nicholas Waterfield 教授首先发现了这一点,在此后很长时间里,人们都认为这只是一种整合到细菌中的没用的垃圾基因。
而最近几年的研究越来越清晰的表明,这种“细菌注射器”潜力巨大,相比目前使用的基于病毒的递送载体,具有更容易、更便宜、更安全等优势,最令人兴奋的是,其具有靶向性,还能递送多种复杂的有效载荷,包括蛋白质、酶和毒素,而不是像病毒载体那样递送基因。
NanoSyrinx公司背后的研究团队更早进行相关研究,他们的知识产权涉及调控和将有效载荷整合到“细菌注射器”中。让该递送系统的重靶向人类细胞显然非常重要送,而在这一点,张锋实验室的这项研究显然做的更好。但 Joseph Healey 认为,这一领域整体还处于非常早期的阶段,现在说什么还太早,大家距离临床应用都还有着一段距离。
目前还不清楚张锋实验室是否已经在“细菌注射器”递送系统领域采取行动,从已知信息来看,张锋团队最接近该领域的是其创立的一家名为Aera Therapeutics的公司,该公司于2023年2月完成类高达1.93亿美元的融资,以开发蛋白质纳米颗粒(PNP)递送系统,利用内源性人类蛋白质,解决当前递送技术的局限。该系统可用于递送一系列基因药物,包括siRNA、ASO、mRNA或CRISPR基因编辑组分。
该公司源于张锋实验室2021年8月在 Science 发表的一篇题为:Mammalian retrovirus-like protein PEG10 packages its own mRNA and can be pseudotyped for mRNA delivery 的研究论文。

根据张锋实验室之前的操作,他大概率会为“细菌注射器”系统专门创立一家新公司,或许这家公司已经创立,只待合适的时间宣布。
论文链接:
https://www.nature.com/articles/s41586-023-05870-7
https://www.genengnews.com/topics/drug-discovery/jpm-2024-nanosyrinx-wields-original-bacterial-syringe-ip-for-protein-delivery/