随着经济发展和人们生活水平提高,肥胖及其相关代谢综合征在全球范围内日渐流行,非酒精性脂肪性肝病(NAFLD)已成为全球慢性肝病中的最常见病种,全球超过四分之一的人口受到影响[1]。
NAFLD是一种进行性疾病,从肝脏内脂肪堆积、脂肪变性开始,到发展为非酒精性脂肪性肝炎(NASH),如果治疗不及时,甚至发展为肝纤维化、肝硬化以及肝癌,并且起病隐匿,可谓“沉默的杀手”,严重危害人类健康。
尽管NAFLD患病率不断攀升,但目前仍缺少有效治疗药物,原因之一是之前该疾病的药物研究主要在啮齿动物中进行,缺乏用于靶点发现和药物筛选的人类相关模型。随着科学技术的发展,NAFLD体外人体模型已经出现,但其对药物筛选的适用性仍未得到证实。
2023年2月23日,荷兰 Hubrecht 研究所Hans Clevers 团队在Nature Biotechnoloy杂志发布题为“Engineered human hepatocyte organoids enable CRISPR-based target discovery and drug screening for steatosis”的研究论文[2],研究者使用人类胎儿肝细胞建立了脂肪肝疾病的新型类器官模型,并建立了一个CRISPR筛选平台,成功筛选到了FADS2基因,明确了肝脏类器官在脂肪变性病因和药物靶点研究方面的可行性,为新药研发提供了新的线索。

DOI: 10.1038/s41587-023-01680-4
NAFLD复杂的发病机制、疾病异质性等为新药的研发带来了巨大的挑战,NAFLD早期阶段的治疗对于降低肝损伤、减缓疾病进展十分重要,值得深入研究。
人类胎儿肝细胞类器官是一种具备成熟体内肝细胞关键特征的培养系统,凭借类器官优越的长期扩增能力,研究者能够使用CRISPR技术对其进行基因工程改造。
在这项研究中,研究团队建立了三种类器官模型来验证脂肪肝发展(脂肪变性)的三种触发因素:游离脂肪酸负荷、个体间遗传变异(PNPLA3I148M)和单基因脂质紊乱(APOB和MTTP突变)。
首先在HEP培养基中建立和培养人胎儿肝细胞类器官系,通过在培养基中补充油酸和棕榈酸(1:1比例)的浓缩混合物,模仿脂肪变性的标志性特征——甘油三酯(TAG)蓄积,诱导人胎儿肝细胞类器官脂肪变性,并且随着脂肪肝的逐渐发展,类器官显示出增殖能力受损。
接下来,研究人员试图模拟NAFLD的遗传易感性。目前普遍认为,编码I148M变异的PNPLA3基因中的rs738409位点是迄今为止最强的遗传危险因素[3],研究者采用不同的CRISPR方法来生成一组完整的人类同基因PNPLA3变体类器官,结果不出所料,PNPLA3基因型直接影响肝细胞内的脂质水平,在标准培养条件下,PNPLA3WT类器官在体内平衡中不会累积脂质,而PNPLA3−/−类器官积累最广泛的脂质(约8%脂肪变性),其次是PNPLA3I148M/I148M类器官(约5%)和PNPLA3WT/I148M类器官。
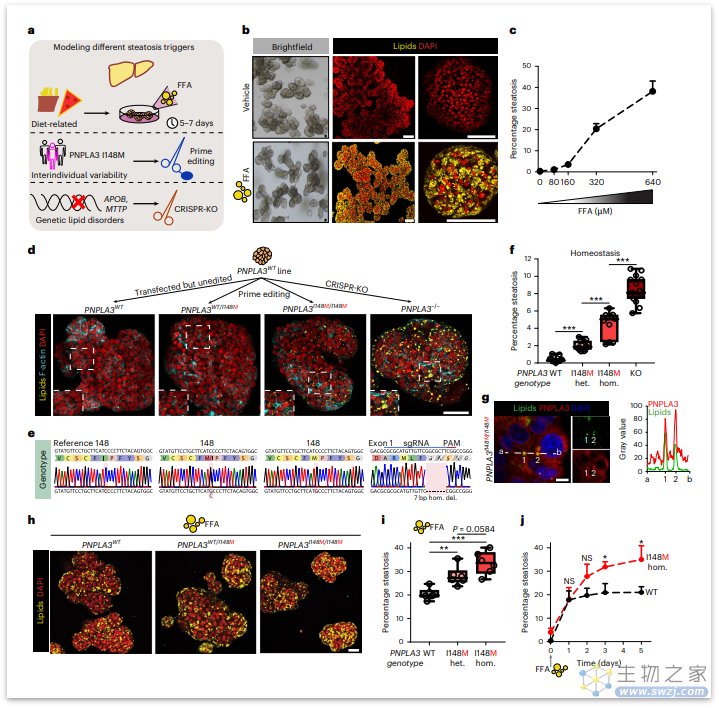
图:人胎儿肝细胞类器官的精确基因编辑评估脂肪变性的遗传易感性(来源:[2])
随后,研究者模拟了两种易患NAFLD的单基因脂质紊乱:家族性低β-脂蛋白血症和无β-脂蛋白血症,这些疾病与APOB和MTTP基因缺失有关。研究者使用CRISPR技术使野生型类器官产生APOB和MTTP突变体,尼罗红染色证实有大量脂质积累。值得注意的是,虽然肝细胞出现了广泛的脂肪变性,但其增殖能力不受影响,与FFA诱导的脂肪肝模型形成了鲜明对比,提示不同方式诱导的脂质积累有不同的细胞反应。
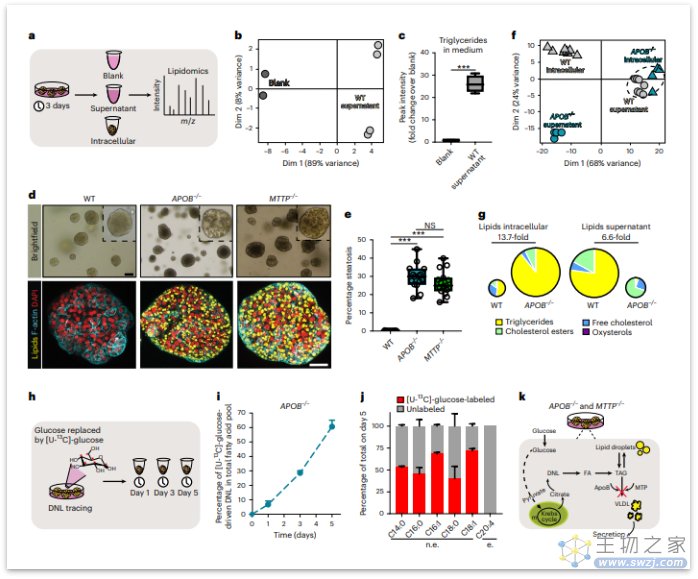
图:通过APOB或MTTP突变产生脂质积累类器官模型(来源:[2])
那么,该类器官模型有什么优势呢?在传统体内研究中,探究某种药物对NAFLD不同阶段的影响并确定对特定细胞类型的作用机制十分困难,而该类器官模型可以构成筛选平台,以识别直接作用于肝细胞以减少脂肪肝发展的药物,并且还可以进一步确定药物反应是否因脂肪肝发展触发因素而异。与此同时,研究者开发了一种脂滴评分系统来定量评估不同模型的药物反应,以对药物有效性进行排名,证实了FFA模型和遗传模型之间的强相关性。
接下来,研究者进一步探究了遗传易感性是否会影响药物治疗反应,选择PNPLA3中评估的五种降低脂肪肝的药物(ACCi,FASi,DGAT2i,FXRa和hFGF19)进行研究。结果发现,携带I148M变体的类器官的药物治疗效果普遍降低,用FXRa和hFGF19治疗后差异最为明显,提示,药物有效性可能会受到遗传风险因素的影响。
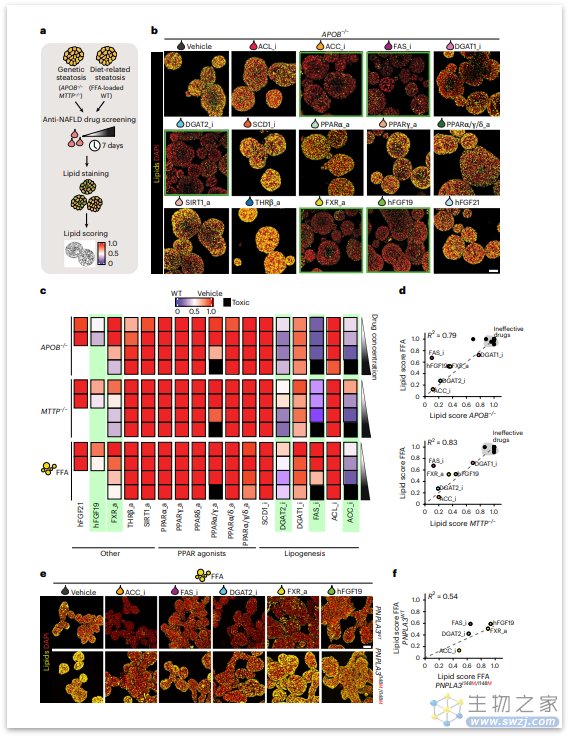
图:人肝脂肪变性不同类器官模型中的药物反应(来源:[2])
在寻找药物靶点的过程中,我们利用APOB和MTTP突变类器官作为实时遗传脂肪变性记录器(FatTracer),用于CRISPR-LOF筛选,以识别脂肪肝调节剂/靶标并评估NAFLD风险基因。为了验证FatTracer在CRISPR-LOF筛选中的使用,研究者纳入了药物筛选中确定的一些有效靶点(即DGAT2,ACC(ACACA/B)和FAS(FASN)),结果肯定了FatTracer作为预测平台,在评估基因对脂肪肝发展水平和细胞表型(如增殖)影响方面的潜力。
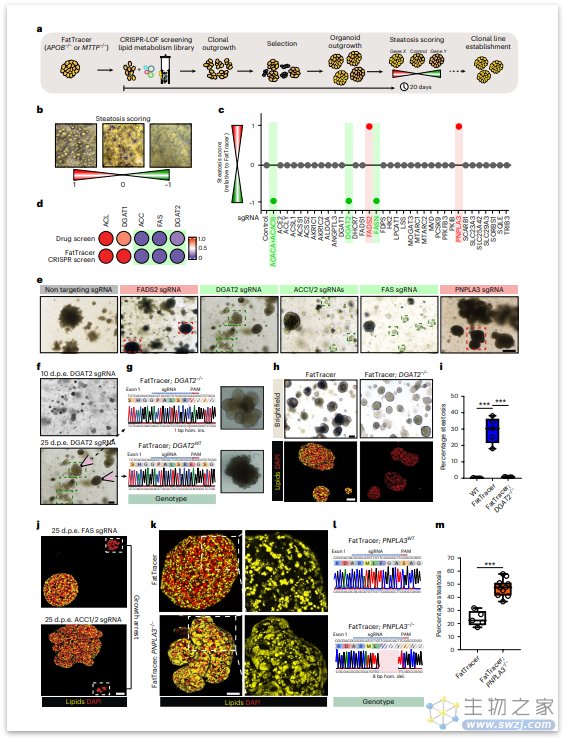
图:FatTracer作为一种识别脂肪变性介质的CRISPR筛选平台(来源:[2])
脂肪酸去饱和酶2(FADS2)是一种δ-6去饱和酶,介导多不饱和脂肪酸(PUFAs)生物合成中的限速步骤。多年来,FADS2在NAFLD中的致病作用未被重视,也没有将FADS2作为潜在靶标进行研究。
为了进一步评估FADS2的作用,研究者制备了FADS2−/−类器官系,发现,与相同FFA剂量的FADS2WT类器官相比,FADS2−/−类器官脂肪肝表型明显加重。该结果进一步为FADS2在平衡脂质稳态中起着重要作用提供了有力证据,这表明FADS2是一个脂肪肝的新的潜在治疗靶点。
紧接着,研究者发现增加FADS2蛋白可以有效地预防和解决脂肪肝发展。从机制上讲,这与甘油三酯(TAG)总含量的降低有关,伴随TAG组成的有利内部变化,其中FADS2活性决定了多不饱和脂肪酸(PUFA)的丰度,从而减少了脂肪的生成,FADS2基因的缺失使得类器官的脂肪含量大大增加。
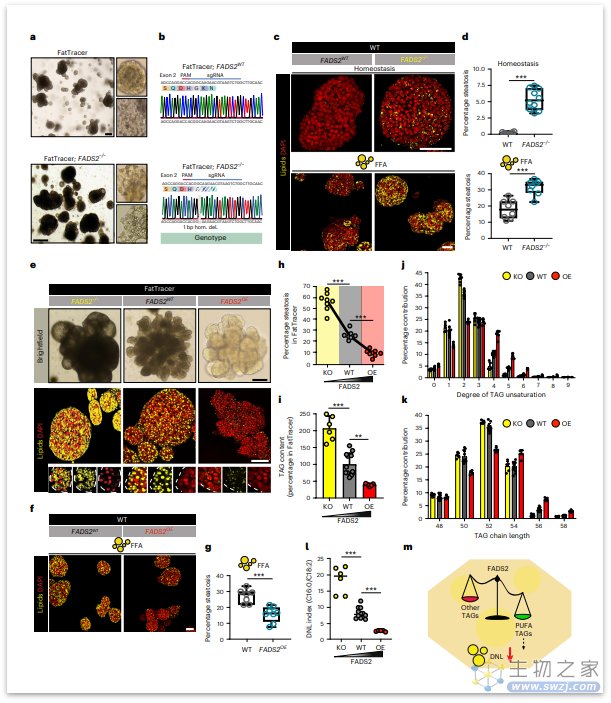
图:FADS2是人肝细胞脂肪肝发展水平的关键调节剂(来源:[2])
综上所述,本研究依托类器官模型,聚焦NAFLD早期脂肪肝发展阶段,取得了令人惊喜的成果。未来,类器官模型及CRISPR药物筛选方法的应用有望扩展到NAFLD-NASH后期阶段,预防及治愈NAFLD任重道远,期待难题被攻克的一天!
参考文献:
[1] Younossi ZM, Koenig AB, Abdelatif D, et al. Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes. Hepatology. 2016 Jul;64(1):73-84.
[2] Hendriks D, Brouwers JF, Hamer K, et al. Engineered human hepatocyte organoids enable CRISPR-based target discovery and drug screening for steatosis. Nat Biotechnol. 2023 Feb 23.
[3] Romeo S, Kozlitina J, Xing C, et al. Genetic variation in PNPLA3 confers susceptibility to nonalcoholic fatty liver disease. Nat Genet. 2008 Dec;40(12):1461-5.































