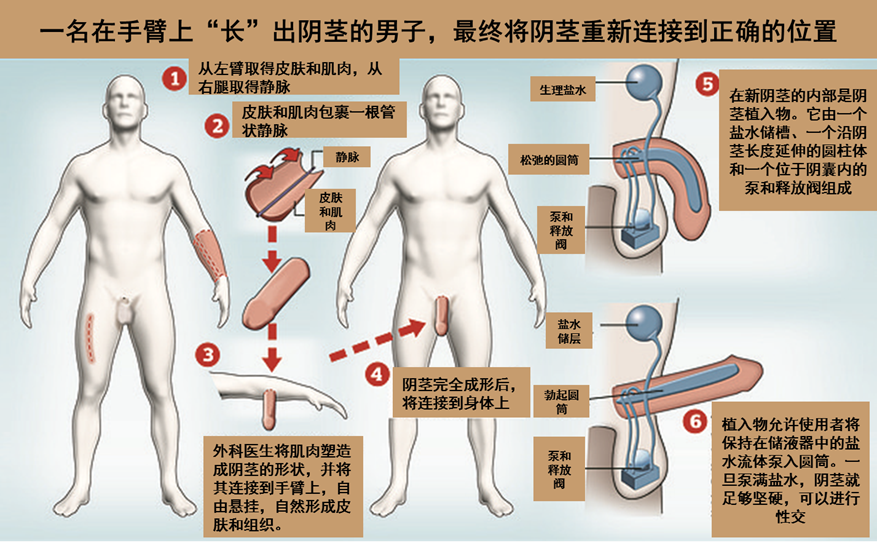
这项研究首次确定了一种损伤反应途径,它不同于病原体触发的经典途径,但与之相似。
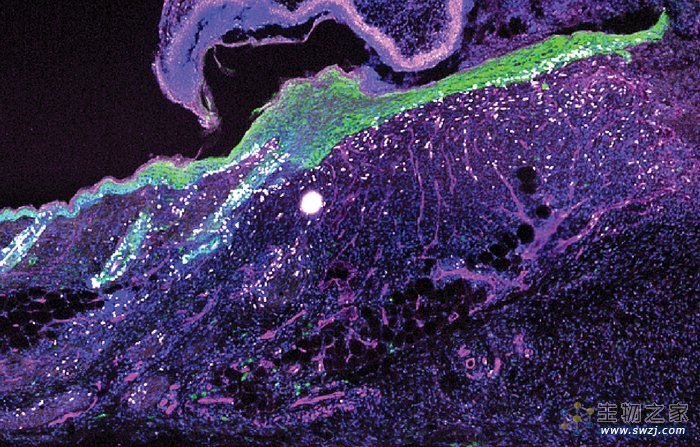
在5天的伤口边缘,多种细胞(白色)增生,包括分泌IL24的表皮干细胞(绿色为上皮基底层)
外面的世界很危险。从细菌和病毒到事故和伤害,威胁每时每刻都围绕着我们。没有什么比我们的皮肤更能保护我们了。身体最大的器官,内外之间的屏障,也是最无缝的防御。然而皮肤并不是不可战胜的。它每天都承受着命运的毒箭,它试图通过感知和应对这些伤害来保护我们的安全。一种主要的方法是检测病原体,从而启动免疫系统。但是,洛克菲勒大学的Elaine Fuchs实验室发表在《Cell》杂志上的一项新研究揭示了另一种保护机制,它对受伤组织中的损伤信号做出反应,包括血管破裂和结痂形成的低氧水平,而且不需要感染就能进入正常状态。这项研究首次确定了一种损伤反应途径,它不同于病原体触发的经典途径,但与之相似。
在这种反应中起主导作用的是白细胞介素-24 (IL24),其基因在伤口边缘的皮肤上皮干细胞中被诱导。一旦释放出来,这种分泌的蛋白质就开始组织各种不同的细胞,开始复杂的愈合过程。
IL24主要由伤口边缘的表皮干细胞产生,但皮肤的许多细胞,如上皮细胞、成纤维细胞和内皮细胞,都表达IL24受体并对信号作出反应。IL24成为协调组织修复的协调者。
病原体诱导的信号提示
长期以来,科学家们一直了解宿主反应如何保护我们的身体免受病原体诱导的威胁:体细胞将入侵的细菌或病毒识别为外来实体,并在信号蛋白(如1型干扰素)的帮助下诱导许多防御机制。但是身体如何对可能或不可能涉及外来入侵者的伤害做出反应呢?例如,如果我们在切黄瓜的时候割伤了手指,我们马上就会知道——会有血和疼痛。然而,在分子的基础上,人们对损伤的检测如何导致愈合知之甚少。
虽然1型干扰素依赖于信号因子STAT1和STAT2来调节对病原体的防御,但Fuchs实验室先前的研究表明,在伤口修复过程中,一种类似的转录因子STAT3也会出现。这两项研究的共同第一作者Siqi Liu想要追踪STAT3的途径,直到它的起源。
IL24作为一个主要的上游细胞因子,在伤口中诱导STAT3激活
在无菌条件下对小鼠进行研究,发现伤口诱导的IL24信号级联不依赖于细菌。但是是什么损伤信号引起了这种级联反应呢?伤口通常会延伸到毛细血管和血管所在的真皮层。
“我们了解到表皮干细胞可以感知伤口的缺氧环境,”该实验室的研究员、论文的共同第一作者Yun Ha Hur说。
当血管被切断并形成痂时,伤口边缘的表皮干细胞就会缺氧。这种缺氧状态是细胞健康的警钟,并诱导了一个涉及转录因子HIF1a和STAT3的正反馈回路,以放大伤口边缘IL24的产生。结果是多种表达IL24受体的细胞通过替换受损的上皮细胞、愈合断裂的毛细血管和为新皮肤细胞生成成纤维细胞来协调修复伤口。通过改变氧气水平来调节IL24基因的表达,一旦研究人员确定了表皮干细胞中组织修复途径的起源,他们就研究了经过基因改造而缺乏IL24功能的小鼠的伤口修复过程。如果没有这种关键蛋白质,愈合过程就会缓慢和延迟,比正常小鼠要多花几天的时间才能完全恢复皮肤。
他们推测IL24可能参与了其他身体器官的损伤反应,这些器官具有上皮层,起到保护鞘的作用。在最近的研究中,在COVID-19重症患者的肺上皮组织和溃疡性结肠炎(一种慢性炎症性肠病)患者的结肠组织中发现了IL24活性升高。
IL24可能是许多器官需要损伤修复的信号。
由功能和进化联系在一起
Fuchs解释说:“我们的发现为独立于感染的重要组织损伤感知和修复信号通路提供了见解。”
IL24及其受体与干扰素家族具有密切的序列和结构同源性。虽然它们可能不是每时每刻都协调工作,但IL24和干扰素在进化上是相关的,它们与细胞表面上彼此靠近的受体结合。研究人员怀疑,这些信号分子源于一条可以追溯到我们过去的共同分子途径。
Liu说:“我们认为,数亿年前,这个祖先可能已经分化成两条途径——一条是病原体防御,另一条是组织损伤。”
也许分裂的发生是为了应对病原体和伤害的爆炸,它们给地球上的生命带来了大量的麻烦。
参考文献
A tissue injury sensing and repair pathway distinct from host pathogen defense