细胞可以说是自然界中最复杂但精密的微型工厂,哪怕是同种类型的细胞,每个细胞所展现出的结构也大有不同。在生物体内,形态十分不同的各类细胞共同构成了复杂的生命体,然而这些看似千差万别的细胞,就起内在的组织方式而言却有着十分惊人的相似性。因此,明确这些细胞的内部组织模式、理解和预测细胞内组织及其作为细胞表型决定因素的关键作用的模型和规律,仍然是该领域的一大谜题。然而,要精确和定量地定义细胞组织,需要进行多方面测量,且异常的细胞数量表型会表现出平均值变化和变异性的变化。因此,需要一个对细胞组织的正式定义和分类,包括对组织单元的平均值和可变性的稳健、客观和定量测量等。

图1 具有不同结构相对位置信息的3D高清细胞结构
最近,为了降低这种复杂性,来自美国艾伦细胞科学研究所的Susanne M. Rafelski等人通过关注细胞组织在代表不同细胞器和功能机器的主要细胞结构层面上,生成了WTC-11 hiPSC单细胞高清图像数据集,包含超过20万个3D活细胞,且含括了25个关键细胞结构。该数据集的规模和质量可以允许创建一个通用的分析框架,从而将细胞及其结构的原始图像数据转换为可直接解读的降维定量测量,并促进数据的深入探索。且该框架包含在正常群体中观察到的巨大细胞间变异性,有助于逐个细胞结构数据的整合,并允许对不同细胞群体内和不同细胞群体之间组织的不同、可分离方面进行定量分析。该研究内容以“Integrated intracellular organization and its variations in human iPS cells”为题于2023年01月04日发表于国际顶级期刊《Nature》,并进行《Research Briefing》专栏报道。

1. 关键科学问题
随着自动化显微镜技术的不断发展,细胞生物学家得以在一天时间内观察并捕获数百甚至数千个活细胞的高分辨率3D图像。但在此基础上,细胞生物学家现在就必须开发出更为强大的统计方法,从而测量和分析所得3D图像中的相似性和差异,这项任务在概念上相对于数据类型的比较(如DNA序列或基因表达水平等)更复杂。因此,为了探索细胞内成分的空间组织及分布,现在亟需开发不仅能测量其平均或典型位置,而且能测量其位置变化的新型分析方法。
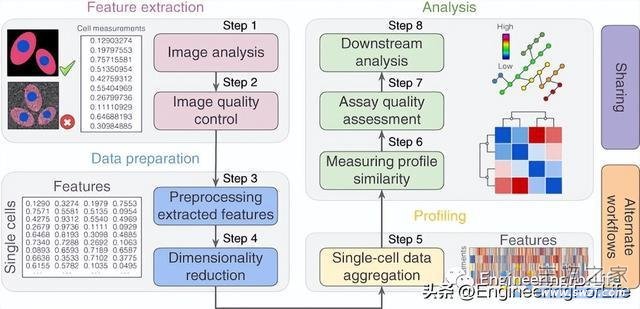
图2 基于图像的细胞分析的代表性工作流
2. 创新型解决方案
为了解决上述问题,该研究构建了25株不同的人诱导多能干细胞2(iPSCs),这些细胞是由已转化为胚胎样状态的成人细胞所产生的,可以进一步产生任何分化的细胞类型。尽管这些细胞系的基因几乎全部相同,但每一个细胞系都经过了基因工程改造,使得每一个具有不同的、特定细胞结构的蛋白质都被荧光标记。基于此,研究成功建立了稳定可重复的自动化分析方法,用以捕获活细胞中荧光标记的3D高清图像以及染料标记细胞膜和细胞核的3D图像。
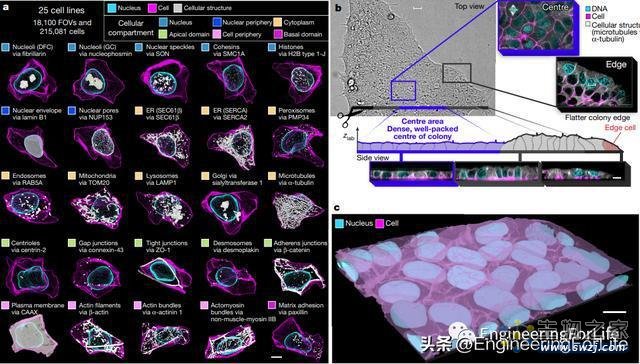
图3 WTC-11 hiPSC单细胞高清图像数据集v1
接下来,研究者们设计了一种从更广泛视野中计算出单个细胞的方法,在实际情况中,即使是同一细胞类型的细胞,其形状也不尽相同,因此研究者构建了一个八维的“形状空间”,其中每个细胞及其细胞核的形状都被表示为了一个点,并且可以从该点的坐标进行精确地重建。在这个八维形状空间中,一些表示具有相似形状的细胞的点被聚集在一起,集群中细胞的形状可以在计算机中被巧妙地挤压和拉伸,从而匹配在形状空间中它们周围的假设“模板”细胞的形状。
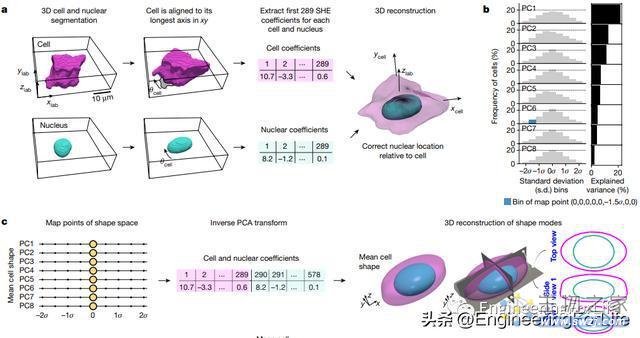
图4 基于PCA的细胞和核形状空间揭示了hiPS细胞形状变化的可能模式
随后,研究将每个细胞进一步细分为一系列的同心壳模型,并绘制其中的荧光标记结构,从而产生了“参数化细胞内位置表示”(PILR),也即是:单个细胞中特定标记结构的坐标(可以理解为细胞内的地图)。通过将这些PILR映射到理想化的模板细胞形状上,研究者们能够准确确定内部结构的平均位置,并比较细胞之间这些位置的变动和差别。基于该方法,研究发现无论细胞的整体形状如何,在所有细胞中,细胞内结构以及那些具有高度可变位置的结构总是在相同的相对位置出现。此外,研究也确定了总是在相似位置发现的成对结构,并测量了细胞在不同状态下的细胞内组织变化,包括菌落边缘的细胞和进入细胞分裂期的细胞。
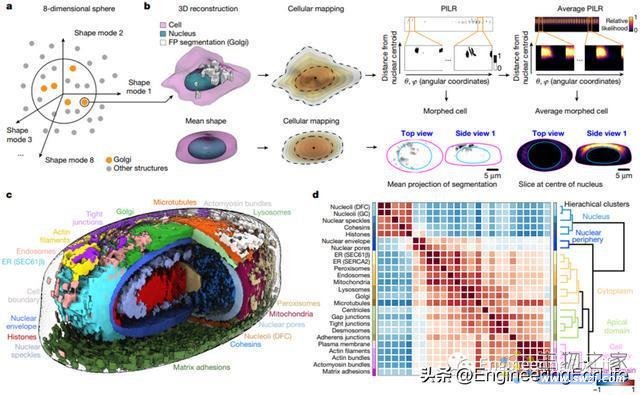
图5 创建细胞结构的平均成对空间相互作用图
3. 总结与研究展望
总结一下,这项研究引入了WTC-11 hiPSC单细胞高清图像数据集v1,并使用该资源数据集开发了整合细胞内组织的分析框架,且进一步将该分析框架应用于间期的大量基线细胞群,以及数据集中的两个细胞亚群。该研究定量细胞内组织的方法具有高度概括的特点:(i)建立细胞形状空间;(ii)生成形状空间内蛋白质定位的参数化表示。这种方法能够对处于不同状态的细胞(如突变体、用药物处理的细胞或正在分化的细胞)的细胞内组织的相似性和差异进行严格的统计比较。该方法可以与现有的细胞状态和细胞身份数据相结合,包括基因表达谱、分子信号状态等,并最终服务于开发细胞状态的全面、定量、多模式分析。
文章来源:
https://www.nature.com/articles/s41586-022-05563-7#Sec32































