" 这项工作将引起细胞生物学界的广泛兴趣,并引起机械生物学界紧迫而显着的兴趣 ""(也)将成为该领域的重要论文。"对于纽约州立大学宾汉姆顿分校生物医学工程系助理教授黎懿增参与的一篇论文,评审专家评价极高并建议尽早发布。

图 | 黎懿增(摄影:Jonathan Cohen)
研究中,她和合作者发现细胞对液体粘度的反应来自于某些分子或蛋白。我们知道癌症的扩散或转移,是癌症患者死亡的主要原因。当癌细胞扩散到身体的其它部位时,它们会穿过具有不同细胞外液粘度的区域。
因此,这一发现对于了解癌症转移的过程至关重要,有望指导癌症疗法的设计,从而抑制癌症的扩散,最终挽救病人的生命。
比如,可以研发能够抑制这些分子或蛋白的药物,并对药物进行测试,以评估药物是否可以阻止癌症的扩散。
(来源:《自然》杂志)
" 一个非常违背直觉的现象 "
据介绍,人体内的细胞总是在与不同的生物体液接触,这些液体的粘性影响着细胞周围液体对细胞的阻力。
以水为例,当其处于 37 摄氏度时,粘度一般是 0.77 厘泊(厘泊是一种粘度单位,1 厘泊等于 1 克每厘米每秒),而人体细胞外液的液体粘度通常在 0.77 厘泊和 8 厘泊之间变化。
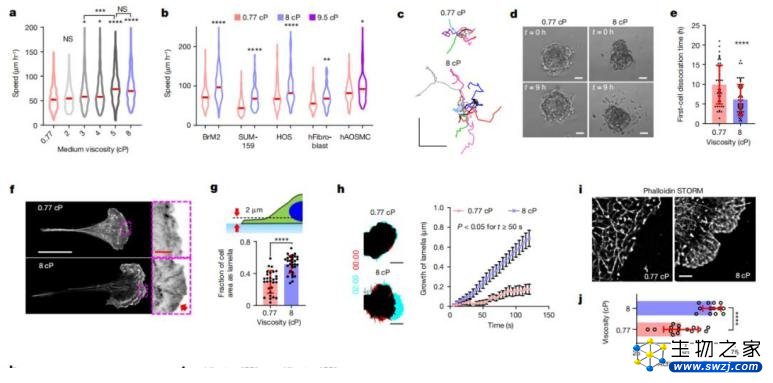
迄今为止,大多数细胞生物学研究都是使用 0.77 厘泊的细胞生长培养液完成的。然而,黎懿增和合作者发现,细胞外液的粘度促进了细胞迁移,即在高粘度的流体环境里面,细胞反而移动得更快。
这是一个非常违背直觉的现象,因为常识告诉我们普通粒子在高粘度的液体里面会减慢运动。在这项研究中,课题组通过一系列的细胞实验和数学模型,从分子和蛋白质的层面,揭示了细胞感知和响应细胞外液粘度背后的生物机制和物理机制。
简单地说,细胞膜上的一些蛋白,在高粘度的液体里会被激活,从而引发一系列的反应,最终致使细胞更加快速地移动。
尤为有意思的是,研究团队发现细胞会对它们所经过的粘度环境产生生物学记忆。也就是说,当预先把细胞暴露于高粘度的流体环境中,再把细胞转移到低粘度的流体中时,细胞仍然保有快速迁移的能力。
为探讨这一研究结果对体内真实环境的意义,课题组建立了一个动物模型。结果发现,当把预先暴露在高粘度流体的癌细胞转移到动物内体时,相比没有在高粘度环境中经历过的细胞,前者更容易在体内扩散。
近日,相关论文以《细胞外液粘度增强细胞迁移和肿瘤播散》(Extracellular fluid viscosity enhances cell migration and cancer dissemination)为题发表在《自然》杂志上 [ 1 ] 。

图 | 相关论文(来源:《自然》杂志)
考斯塔 · 夫贝拉(Kaustav Bera)博士是该论文的第一作者,约翰霍普金斯大学化学与生物分子工程教授康斯坦提诺斯 · 康斯坦托普洛斯(Konstantinos Konstantopoulos)为通讯作者。
其中有一位审稿人可能是想更多了解细胞外液粘度对细胞运动的影响,一共提出 了 51 个问题。
而从基础研究的角度来看,通过对该成果做进一步的扩展,可以了解细胞保留粘度记忆的机制。同时,还可以研究动物体内的细胞暴露于不同细胞外液粘度下的行为状态。
此外,本次研究表明液体粘度是一种与细胞生物学反应息息相关的物理信号,因此除了研究肿瘤细胞迁移和癌症转移之外,还需要关注液体粘度对其它生物过程的影响。
(来源:《自然》杂志)
既古老又重要的话题:哺乳动物体细胞的移动
哺乳动物体细胞的移动是一个很古老也很重要的问题,很多生物过程譬如免疫响应、伤口愈合、组织再生、癌症转移等,都牵涉到细胞的移动。
鉴于这一问题的重要性,学界对其研究由来已久,大家公认的观点是细胞内与细胞外的力学环境很重要。
但是,对于力学环境的研究也往往局限于固体层面的研究,比如细胞周围的弹性、硬度、密度等,而对流体环境的研究一直相对较少。
可以说,流体的影响被忽略,或者说之前人们根本没有想到流体环境会对细胞力学产生影响。这些年来,通过生物实验和数学模型的研究,黎懿增和约翰霍普金斯大学的合作者发现:流体的阻力也是影响细胞力学的一个重要因素。
流体阻力可以是多方面的,例如液体的静态压力和粘性,都能增加流体对所包围物体的阻力。近年来,该团队在发表于 Nature Communications、Science Advances、Advanced Science、PNAS 等期刊的论文中,已经阐述过关于流体阻力的重要性。
凭借团队在这方面的贡献,论文作者之一的约翰霍普金斯大学机械工程系教授肖恩 X. 孙(Sean X. Sun)还受邀撰写过一篇关于流体环境对细胞力学重要性的综述性论文。
" 而这次发表在《自然》杂志上的论文,是针对液体粘性对细胞影响的探讨,是我们一系列论文里面的又一个重要里程碑。有的学者在网上评论说,这一系列论文非常有开创性,把人们的视野扩展到了一个新的领域:即流体环境对细胞的影响。自此以后,对于细胞力学的研究,将不再限于固体力学的层面,还将拓展到流体力学层面。" 研究人员表示。
在这些研究中,实验部分由黎懿增的合作者完成。黎懿增则是理论力学和应用数学背景出身,故主要负责建立数学模型。
她说:" 我想要强调的是,力学在细胞生物学里面有非常重要的作用,而数学模型又可以在宏观或微观的机理上对细胞现象进行解释或预测。" 在过去,她建立过很多有着不同尺度、不用类别的数学模型,并将其用于生物力学的研究。
可以说,流体对于细胞的重要性,不仅仅停留在基础理论层面,更重要的是人体内 60% 都是水,而且在不同的组织器官内,液体的生物化学成分、以及物理特性都不一样。
因此,我们不能孤立地看待流体,而是要放在体内的大环境下,在不同生理和病理的条件下,去理解组织器官内的流体性质是如何发生改变的,以及这种改变对于细胞活动有什么意义。

(来源:《自然》杂志)
经历过高粘性的癌细胞,在动物体内扩散得更快
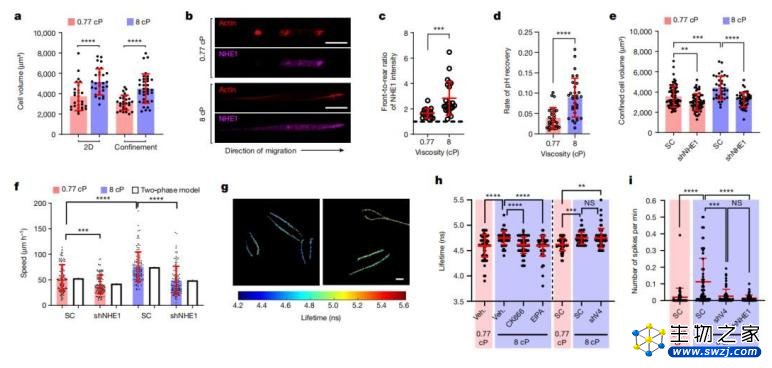
据介绍,在本次研究中,当课题组首次观察到细胞在高粘度液体中会加速迁移这个违反直觉的现象后,接下来的第一步工作便是确定到底哪些分子是这一过程的参与者。
他们发现细胞可以探测并响应其周围液体的粘度,而体液粘度的变化可以由生理变化引起。
研究团队还进行了一系列体外实验,并使用数学模型验证了关键发现。在体外实验里,当一系列生物信号级联反应得到阐明之后,就能测试这种反应是否也会在不同动物的体内环境里发生。
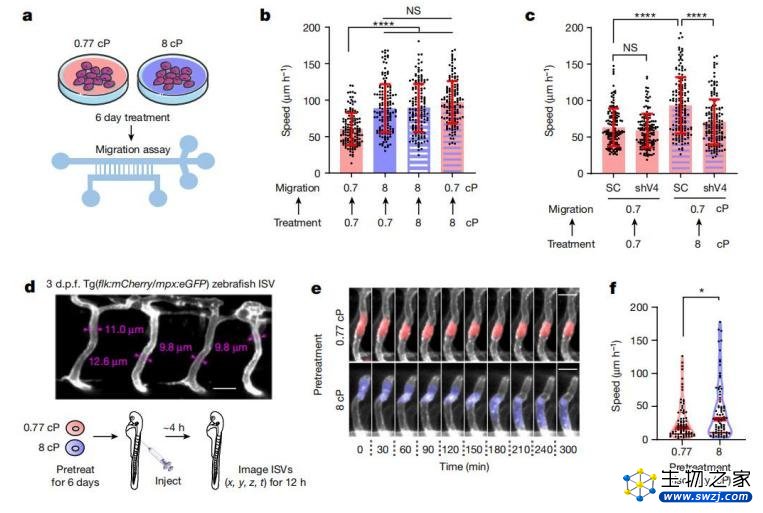
具体来说,课题组使用三种不同的实验动物来验证实验结果:分别是斑马鱼、鸡胚胎和小鼠。结果都显示:经历过高粘性的癌细胞,在动物体内扩散得更快。
另据悉,在细胞膜上有一些特定的离子通道会对机械力做出反应。因此,目前学界公认的关于细胞如何感知物理力的观点,可能是通过离子通道做出的初始响应。
(来源:《自然》杂志)
然而在这项研究中,他们发现首先感知细胞外液粘度的结构,是细胞内不断生长的肌动蛋白丝。肌动蛋白丝通常在细胞内构建支架,并为细胞提供力学上的结构。
但是,直到最近几十年肌动蛋白丝才被证明是对力敏感的,即在不同的力学环境下,肌动蛋白丝的生长也不相同。
因此,此次发现可能具有广泛的生物学意义,因为几乎所有的细胞生物学实验室都依赖细胞培养液来进行研究。未来,科学家们还会用更多有趣的研究来确定液体粘度在不同生理过程中可以发挥的作用。
论文通讯作者康斯坦提诺斯 · 康斯坦托普洛斯教授表示,后续的研究包括在动物实验中建立复杂的成像和传感策略,以了解动物体内的细胞如何对不同粘度的液体做出精确响应的。
研究团队希望这些研究不仅可以帮助临床医生更好地治疗癌症转移,还可以帮助他们在癌症早期危害较小的时候及时发现癌症。此外,在科学发展中,每当向一个新领域或新概念迈进时,人类对于自然的认识便有了质的进步。
参考资料:
1.Kaustav Bera, Alex Kiepas*, In ê s Godet*, Yizeng Li*, Pranav Mehta*, Brent Ifemembi, Colin D. Paul, Anindya Sen, Selma A. Serra, Konstantin Stoletov, Jiaxiang Tao, Gabriel Shatkin, Se Jong Lee, Yuqi Zhang, Adrianna Boen, Panagiotis Mistriotis, Daniele M. Gilkes, John D. Lewis, Chen-Ming Fan, Andrew P. Feinberg, Miguel A. Valverde, Sean X. Sun, Konstantinos Konstantopoulos. Extracellular fluid viscosity enhances cell migration and cancer dissemination. Nature. 611 ( 7935 ) , 365 – 373 ( 2022 ) ( *Equal Contribution )
2.Yuqi Zhang, Yizeng Li, Keyata N. Thompson, Konstantin Stoletov, Qinling Yuan, Kaustav Bera, Se Jong Lee, Runchen Zhao, Alexander Kiepas, Yao Wang, Panagiotis Mistriotis, Selma A. Serra, John D. Lewis, Miguel A. Valverde, Stuart S. Martin, Sean X. Sun, and Konstantinos Konstantopoulos. Polarized NHE1 and SWELL1 Regulate Migration Direction, Efficiency and Metastasis. Nat. Commun. 13, 6128 ( 2022 )
3.Debonil Maity, Kaustav Bera, Yizeng Li, Zhuoxu Ge, Qin Ni, Konstantinos Konstantopoulos, Sean X. Sun. Extracellular Hydraulic Resistance Enhances Cell Migration. Adv. Sci. 9 ( 29 ) , 2200927 ( 2022 )
4.Mohammad Ikbal Choudhury, Yizeng Li, Panagiotis Mistriotis, Ana Carina N. Vasconcelos, Eryn Dixon, Jing Yang, Morgan Benson, Debonil Maity, Rebecca Walker, Leigha Martin, Fatima Koroma, Feng Qian, Konstantinos Konstantopoulos, Owen Woodward, Sean X. Sun. Kidney Epithelial Cells are Active Mechano-biological Fluid Pumps. Nat. Commun. 13, 2317 ( 2022 )
5.Yizeng Li, Konstantinos Konstantopoulos, Runchen Zhao, Yoichiro Mori, Sean X. Sun. The importance of water and hydraulic pressure in cell dynamics. J. Cell Sci. 133 ( 20 ) , jcs240341 ( 2020 )
6.Yizeng Li, Lingxing Yao, Yoichiro Mori, Sean X. Sun. On the Energy Efficiency of Cell Migration in Diverse Physical Environments. Proc. Natl. Acad. Sci. USA 116 ( 48 ) , 23894 – 23900 ( 2019 )
7.Runchen Zhao, Alexandros Afthinos, Tian Zhu, Panagiotis Mistriotis, Yizeng Li, Selma A. Serra, Yuqi Zhang, Christopher L. Yankaskas, Shuyu He, Miguel A. Valverde, Sean X. Sun, Konstantinos Konstantopoulos. Cell Sensing and Decision-Making in Confinement: The role of TRPM7 in the tug of war between hydraulic pressure and cross-sectional area. Sci. Adv. 5 ( 7 ) , eaaw7243 ( 2019 )
8.Debonil Maity, Yizeng Li, Yun Chen, Sean X. Sun. Response of Collagen Matrices under Pressure and Hydraulic Resistance in Hydrogel. Soft Matter 15 ( 12 ) , 2617 – 2626 ( 2019 )
9.Yizeng Li, Sean X. Sun, Transition between actin-driven and water-driven cell migration depends on the external hydraulic resistance. Biophys. J. 114 ( 12 ) , 2965 – 2973 ( 2018 )































